
Tips Mudah Membedakan Larutan Elektrolit Kuat, Lemah, Non Elektrolit, & Derajat Disosiasi
Reaksi ionisasi adalah modal dasar dalam membuat persamaan reaksi kimia. Tapi ingat ya ada yang unik : jika unsur golongan 2 (Be Mg Ca Sr Ba Ra) bertemu golo.
PPT LARUTAN ELEKTROLIT DAN NON ELEKTROLIT PowerPoint Presentation, free download ID4715206
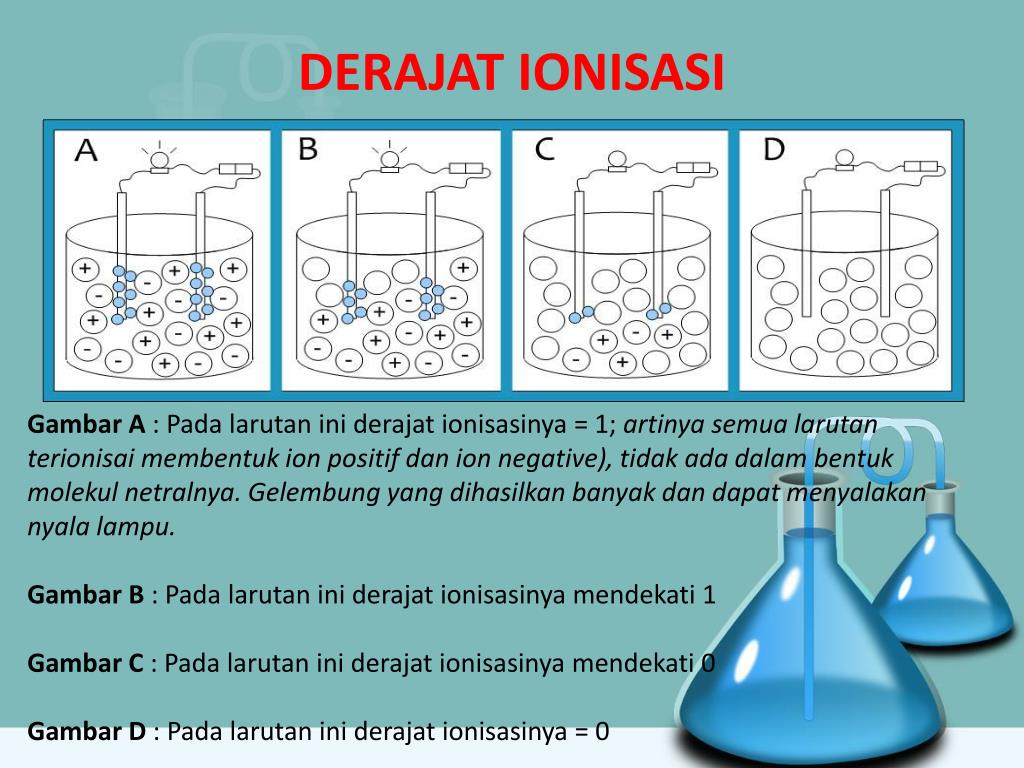
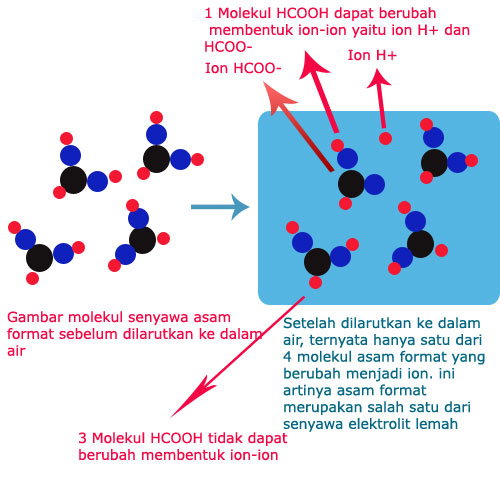
"Derajat ionisasi adalah suatu perbandingan antara jumlah molekul zat yang terionisasi dengan jumlah molekul zat pada keadaan mula-mula" Lambangnya yaitu α (alpha). Dengan begitu, kita bisa memperoleh rumus derajat ionisasi dari pengertian di atas sebagai berikut: Rumus α = (jumlah molekul zat

Larutan elektrolit, non elektrolit, derajat ionisasi, dan faktor van't hoff Ilmu Siswa
Larutan Elektrolit dan Non Elektrolit (K13R K10, Kumer Fase F) Pengertian Larutan dan Proses Pelarutan Senyawa Ionik dan Kovalen Polar. Daya Hantar Listrik Larutan. Derajat Ionisasi. Ringkasan - Larutan Elektrolit dan Non-elektrolit. Tes Evaluasi 1 - Larutan Elektrolit dan Non Elektrolit.

30 Contoh Larutan Elektrolit dan Non Elektrolit
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi. Baca juga.

PPT LARUTAN ELEKTROLIT DAN NON ELEKTROLIT PowerPoint Presentation, free download ID4011706
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut: Sifat larutan elektrolit: Dapat menghantarkan listrik. Memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1. Jika dinyalakan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala.
Pengertian Dan Penjelasan Mengenai Derajat Ionisasi Panduan Kimia + Riset
Materi Derajat Ionisasi Derajat Ionisasi Part 2 Lp 25787 - Kelas 10 Kimia. Belajar. Kelas 10 - Kimia. Larutan Elektrolit Dan Non Elektrolit K 13 RK 10 Kumer Fase F. Derajat - Derajat Ionisasi Part 2. 0:00 / 7:30. 1 X. Kamu lagi nonton preview, nih. Masuk buat beli paket dan lanjut belajar.

Derajat Ionisasi Larutan Elektrolit YouTube
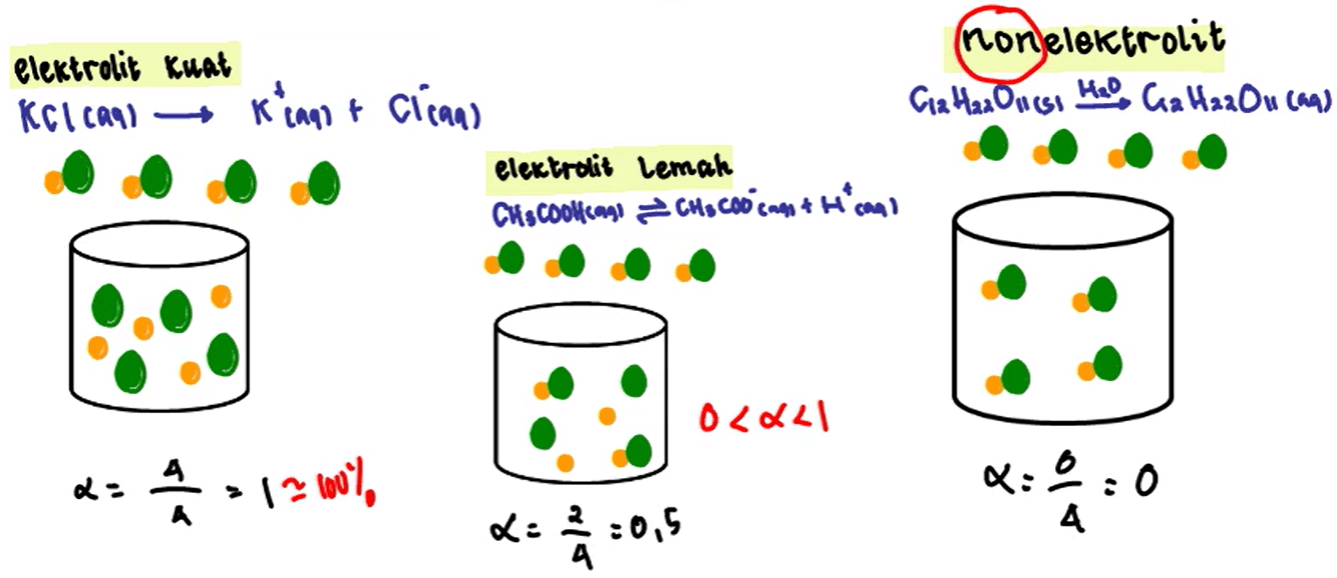
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
Derajat Ionisasi adalah proses di mana atom atau molekul diubah untuk ion dengan menambah atau mengurangi partikel bermuatan seperti elektron atau ion. derajat ionisasi garam, derajat ionisasi h2o, derajat ionisasi non elektrolit, derajat ionisasi rumus, lambang derajat ionisasi. Arti Mimpi Tidur Diatas Ayunan - Menurut Islam dan Psikolog.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
Berdasarkan derajat ionisasi tersebut, dapat disimpulkan jenis-jenis larutan, yaitu: elektrolit kuat. Jika 0 elektrolit lemah. 0, maka zat tidak terionisasi dan merupakan larutan non elektrolit. Semakin besar derajat ionisasi, semakin besar harga tetapan keseimbangan asam atau basa. Harga keseimbangan asam atau basa dapat digunakan untuk

Larutan Elektrolit Dan Non Elektrolit Serta Derajat Ionisasi Nya My XXX Hot Girl
Larutan non-elektrolit akan mengalami ionisasi sebagian, dapat menghantarkan arus listrik,. (Derajat ionisasi), jika melihat persamaan reaksi, dapat kita lihat persamaan reaksi ditandai dengan satu arah panah ke kanan, terdiri dari kelompok senyawa-senyawa asam kuat, basa kuat dan garam 8 Ciri-ciri larutan non-elektrolit yang benar di bawah.

Larutan Elektrolit dan Non Elektrolit (Kompone
Derajat Ionisasi. Salah satu perbedaan larutan elektrolit dan non elektrolit lainnya adalah derajat ionisasinya. Jika kamu belum tahu, derajat ionisasi adalah parameter larutan elektrolit yang berupa perbandingan antara jumlah zat yang mengion dengan jumlah zat mula-mula. Untuk mengetahui nilainya, kamu bisa menggunakan rumus berikut:

Larutan Elektrolit dan Non Elektrolit
Semakin besar α ( derajat ionisasi) maka akan semakin besar proporsi jumlah molekul yang terionisasi. Faktanya kalau dihitung benar-benar tidak ada zat atau senyawa yang punya nilai α 0 ataupun 1. Munculnya nilai α = 0 atau α =1 biasanya hanya untuk mempermudah penghitungan. Jadi derajat ionisasi akan berbanding lurus dengan kekuatan.

Soal derajat ionisasi (kimia)
Elektrolit kuat akan memiliki derajat ionisasi sempurna, yaitu α=1. Kalau dalam persen berarti 100%. Elektrolit lemah akan memiliki derajat ionisasi 0<α<1, atau α=0,5. Non elektrolit gak memiliki derajat ionisasi, α=0. Bagaimana Cara Mencari Derajat Ionisasi? Lo bisa menghitungnya menggunakan rumus . Perhatikan contoh soal derajat ionisasi.
Rumus Derajat Ionisasi & Contoh Soal Materi Kimia Kelas 10 115
Non Elektrolit: Bisa menghantarkan listrik: Tidak bisa menghantarkan listrik karena tidak terionisasi: Derajat ionisasi antara 0 < ɑ < atau = 1:. Rumus Derajat Ionisasi Elektrolit. Dalam mempelajari derajat ionisasi, pengertian, rumus dan contohnya, salah satu yang penting untuk dipahami adalah rumus derajat ionisasi yang akan dijelaskan.

Derajat Ionisasi Larutan Y Adalah
Pemahaman tentang larutan elektrolit dan non elektrolit, serta konsep derajat ionisasi dan faktor van't Hoff, memiliki aplikasi luas dalam berbagai bidang. Dalam kimia, ini membantu kita memahami reaksi dan sifat larutan yang kompleks. Dalam ilmu kesehatan, ini memainkan peran penting dalam pemahaman tentang bagaimana obat-obatan berinteraksi.

Larutan elektrolit, non elektrolit, derajat ionisasi, dan faktor van't hoff Ilmu Siswa
Derajat ionisasi (𝛼), 0 (𝛼) 1.Contoh larutan elektrolit lemah: Basa = Be(OH)₂, Mg(OH)₂, dan beberapa basa dari logam transisi.. Pada larutan non elektrolit, senyawa dalam air tidak mengalami proses ionisasi. Larutan non-elektrolit tidak dapat terionisasi dalam air, maka 𝛼 = 0.