
PPT REAKSI REDUKSI OKSIDASI PowerPoint Presentation, free download ID5653756
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
.png)
Reaksi Redoks Pengertian, Ciri, Konsep, dan Menentukan BIlangan Oksidasi
Cobalah Anda perhatikan contoh berikut: Reaksi Mg(s) + 2HCl —-> MgCl2(aq) + H2(g) Sebab Mg adalah unsur bebas, sehingga bilangan oksidasi Mg = 0. Kemudian, bilangan oksidasi H pada senyawa 2HCl bernilai +1 sebab unsur H berhubungan dengan unsur lain dan H merupakan golongan dari IA.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10 Belajar Gratis di Rumah
9. Contoh reaksi oksidasi adalah . . . a. Ag + (aq) berubah menjadi Ag (s) b. Cl 2 (g) berubah menjadi Cl‾ (aq) c. I - (aq) berubah menjadi I 2 (s) d. Cr 6+ berubah menjadi CrO 4¯². e. H 2 O (l) berubah menjadi OH‾ (aq) Jawaban : C. Pembahasan : Oksidasi yaitu dimana bertambahnya bilangan oksidasi. Maka unsur di atas yang mengalami.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Reaksi Oksidasi. reaksi oksidasi adalah reaksi yang terjadi peningkatan bilangan oksidasi melalui pelepasan elektron atau penambahan oksigen pada suatu molekul, atom, maupun ion. Contohnya :. yaitu merupakan reaksi dimana suatu zat dapat mengalami reaksi reduksi dan oksidasi. Contoh : Pada reaksi diatas, Cl2 mengalami reduksi menjadi KCl.

REAKSI HIDROKARBON (OKSIDASI, SUBTITUSI, ADISI DAN ELIMINASI) YouTube
Bilangan oksidasi oksigen (O) dalam senyawa peroksida adalah -1, sedangkan dalam senyawa non-peroksida adalah -2. Sebagai contoh, bilangan oksidasi O dalam BaO2 adalah -1. Menentukan Reaksi Reduksi dan Oksidasi Berdasarkan Konsep Kenaikan dan Penurunan Bilangan Oksidasi. Dalam reaksi redoks, ada unsur-unsur yang berperan sebagai agen pereduksi.

Contoh Reaksi Oksidasi Dan Reduksi cara pasang bondek yang benar
Reaksi redoks adalah reaksi yang dapat mengalami perubahan bilangan oksidasi sebagai berikut. Reaksi oksidasi : reaksi kenaikan biloks; Reaksi reduksi : reaksi penurunan biloks; Pada soal di atas, yang merupakan reaksi oksidasi adalah karena terjadi kenaikan bilangan oksidasi dari -1 menjadi 0. Jadi, jawaban yang benar adalah C.

Contoh Soal Reduksi Oksidasi
Oksidasi dalam Reaksi Redoks, Begini Penjelasannya. Ilustrasi besi berkarat, yang merupakan contoh akibat reaksi oksidasi dalam kehidupan sehari-hari. (Rengga Sancaya) Oksidasi adalah bagian dari fenomena kimia yang disebut dengan reaksi redoks. Ternyata, reaksi oksidasi dapat ditemukan di sekitar kita lho.

Oksidasi dan Reduksi Ilmu Kimia
2Fe 2 O 3. Bilangan oksidasi Fe pada FeO adalah +2 sedangkan pada Fe 2 O 3 adalah +3, karena terjadi penambahan bilangan oksidasi dari +2 menjadi +3 maka reaksi tersebut merupakan reaksi oksidasi. FeO bertindak sebagai reduktor, dan hasil oksidasinya adalah Fe 2 O 3.. Baca juga: Mengenal Ikatan Hidrogen. Bilangan Oksidasi

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Contoh Reaksi Redoks. Salah satu contoh dari reaksi redoks adalah reaksi antara hidrogen dan fluorin. H2 + F2 → 2HF. Maka, kita dapat menulis keseluruhan reaksi menjadi dua setengah reaksi. Reaksi oksidasi: H2 → 2H+ + 2e- Reaksi reduksi: F2 + 2e- → 2F- Mari kita analisa masing-masing setengah reaksi.

Reaksi berikut yang merupakan reaksi oksidasi adalah....
3 Konsep Reaksi Redoks dan Contohnya Dalam ilmu kimia, mengutip Modul Kimia terbitan Kemdikbud (), setidaknya dikenal ada tiga konsep reaksi redoks (reduksi-oksidasi). Ketiga konsep itu adalah reaksi redoks berdasarkan keterlibatan atom oksigen, reaksi redoks berdasarkan transfer elektron, dan reaksi redoks berdasarkan konsep bilangan oksidasi.

PPT KONSEP REAKSI REDUKSIOKSIDASI PowerPoint Presentation, free download ID5404853
Cobalah Anda perhatikan contoh berikut: Reaksi Mg(s) + 2HCl —-> MgCl2(aq) + H2(g) Sebab Mg adalah unsur bebas, sehingga bilangan oksidasi Mg = 0. Kemudian, bilangan oksidasi H pada senyawa 2HCl bernilai +1 sebab unsur H berhubungan dengan unsur lain dan H merupakan golongan dari IA.
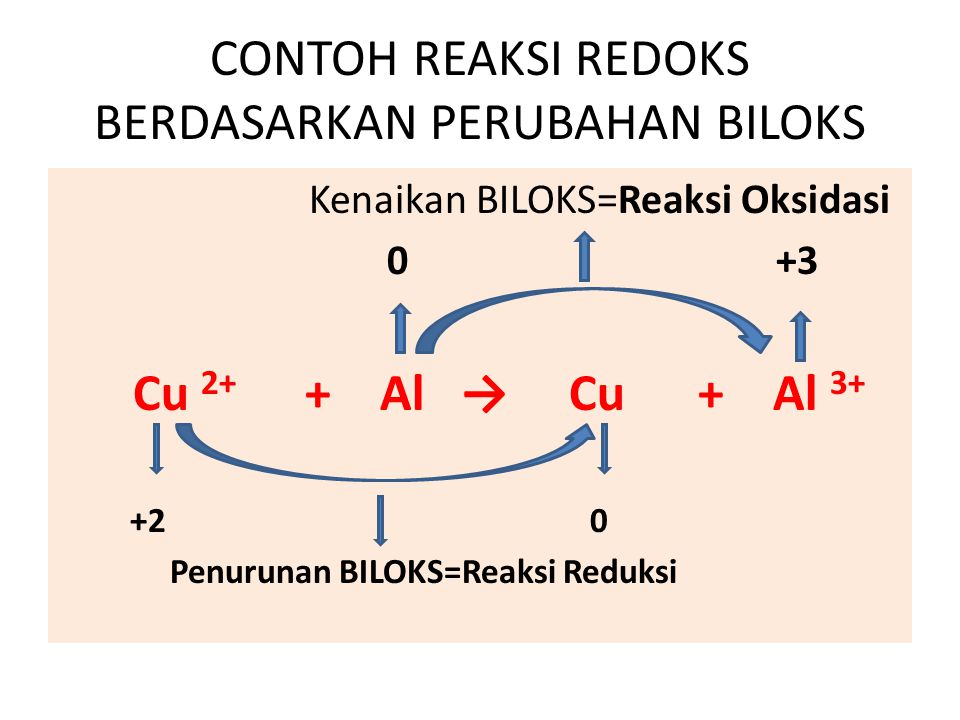
Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Kaitan Antara Reaksi Oksidasi dan Reduksi. Dalam banyak situasi, reaksi oksidasi dan reduksi terjadi secara bersamaan, membentuk apa yang disebut sebagai reaksi redoks. Contoh klasik dari reaksi redoks adalah reaksi antara logam dan non-logam, seperti pembakaran logam alkali seperti natrium Na dalam udara: 4 N a + O 2 → 2 N a 2 O 4Na + O.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Redoks. Redoks atau redox adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH 4 ), ataupun ia dapat berupa proses.

Reaksi oksidasi soal kimia SMA YouTube
Contoh: ion NH4+ jumlah bilangan oksidasi unsur N adalah -3, dan H adalah +1. Penyetaraan Reaksi Redoks Pada dasarnya reaksi redoks berlangsung di dalam pelarut air sehingga penyetaraan persamaan reaksi redoks selalu melibatkan ion H+ dan OH-.

Mekanisme Reaksi Oksidasi Alkohol dengan Reaksi Oksidasi Swern YouTube
1. Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Dalam teori ini, Reaksi Oksidasi adalah reaksi pengikatan suatu zat dengan oksigen sedangkan reaksi reduksi adalah reaksi pelepasan oksigen oleh suatu zat. Contoh Reaksi Oksidasi : 1. C + O 2 → CO 2 2. 2Fe + 3O 2 → 2Fe 2 O 3. Contoh Reaksi Reduksi : 1. 2SO 3 → 2SO 2 + O 2 2. 2PbO → 2Pb + O 2. 2. Berdasarkan Pengikatan dan Pelepasan Elektron