
Covalent Bond Types
2. Ikatan Kovalen Non Polar. Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara (sama). Biasanya terjadi ketika ada atom mempunyai afinitas elektron yang sama atau hampir sama. Semakin dekat nilai afinitas elektron, maka semakin kuat ikatannya.

X.2.f. Ikatan Kovalen Tunggal, Rangkap Dua, dan Rangkap Tiga (Teori) YouTube
Sementara, jika dilihat berdasarkan kepolarannya, ikatan kovalen terdiri dari ikatan kovalen polar dan non polar. Berikut adalah jenis-jenis ikatan kovalen lengkap dengan contoh senyawanya. 1. Kovalen Tunggal. Ikatan kovalen tunggal merupakan ikatan yang menggunakan satu pasang elektron. Umumnya, ikatan ini juga disebut sebagai ikatan kovalen.

ecochemical Senyawa Kovalen Polar dan NonPolar
Ada tiga jenis ikatan Kimia, yaitu ikatan kovalen, ikatan logam dan ikatan ion. Sementara itu, dalam membentuk ion, suatu atom akan melepas atau mengikat elektron. Atom-atom yang mempunyai energi ionisasi rendah, misalnya atom-atom dari unsur golongan IA dan IIA dalam sistem periodik unsur akan mempunyai kecenderungan untuk melepaskan elektronnya.

Contoh Senyawa Ion Dan Senyawa Kovalen Polar Yang Tergolong Zat Sexiz Pix
Senyawa kovalen non polar juga biasanya memiliki bentuk gas atau cair pada suhu kamar. Baca juga: Ikatan Kovalen Koordinasi: Pengertian dan Contohnya. Ikatan kovalen non polar terjadi karena kesamaan keelektronegativan atom-atom yang saling terikat. Di mana jika perbedaan keelektronegativan dua atom di bawah 0,4.

Ikatan kovalen Polar dan Non Polar Alsen Saloka Blog's
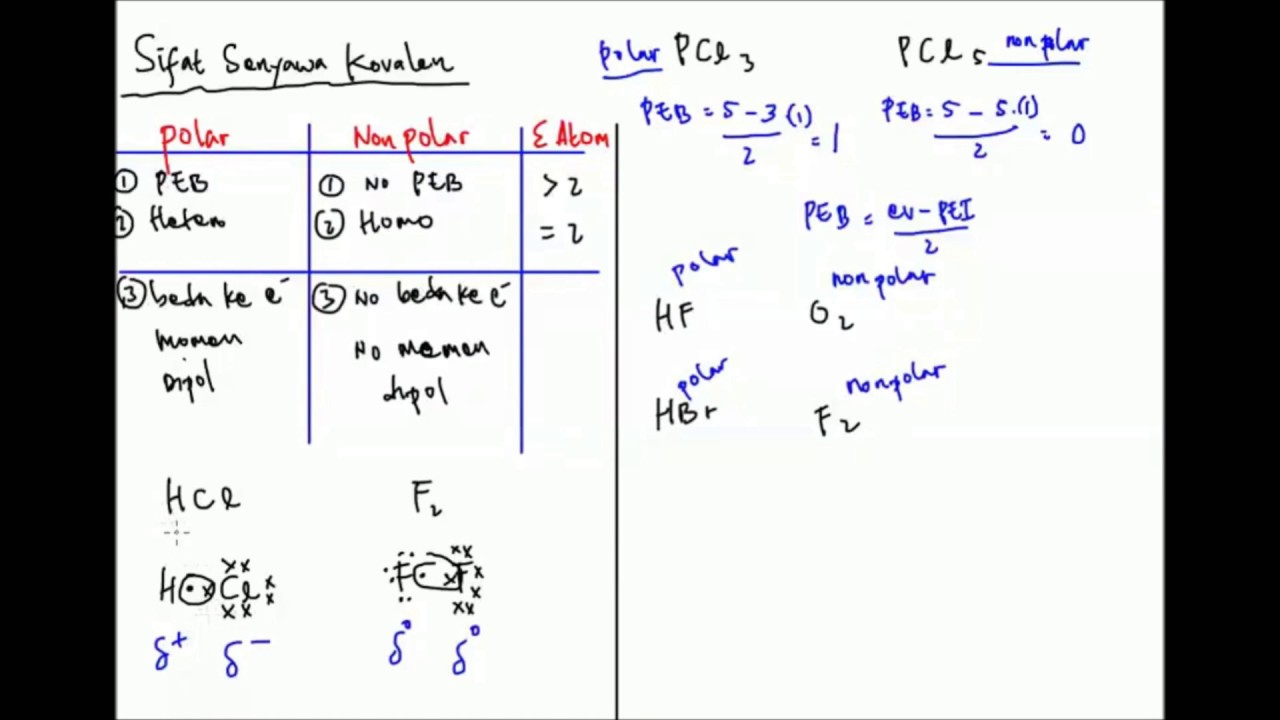
1 H = 1. 53 I = 2 8 18 18 7. Struktur Lewis HI. H-I. Karena terdapat perbedaan keelektronegatifan, maka senyawa HI termasuk senyawa polar. 3. SiCl 4. Ikatan antara 14 Si dengan 17 Cl. 14 Si = 2 8 4. 17 Cl = 2 8 7. Struktur Lewsi SiCl 4. Karena atom pusat tidak memiliki pasangan elektron bebas (PEB), maka senyawa SiCl 4 termasuk senyawa nonpolar.. 4.

🔴IKATAN KOVALEN POLAR & NON POLAR, 🔴SENYAWA KOVALEN POLAR DAN SENYAWA KOVALEN NONPOLAR YouTube
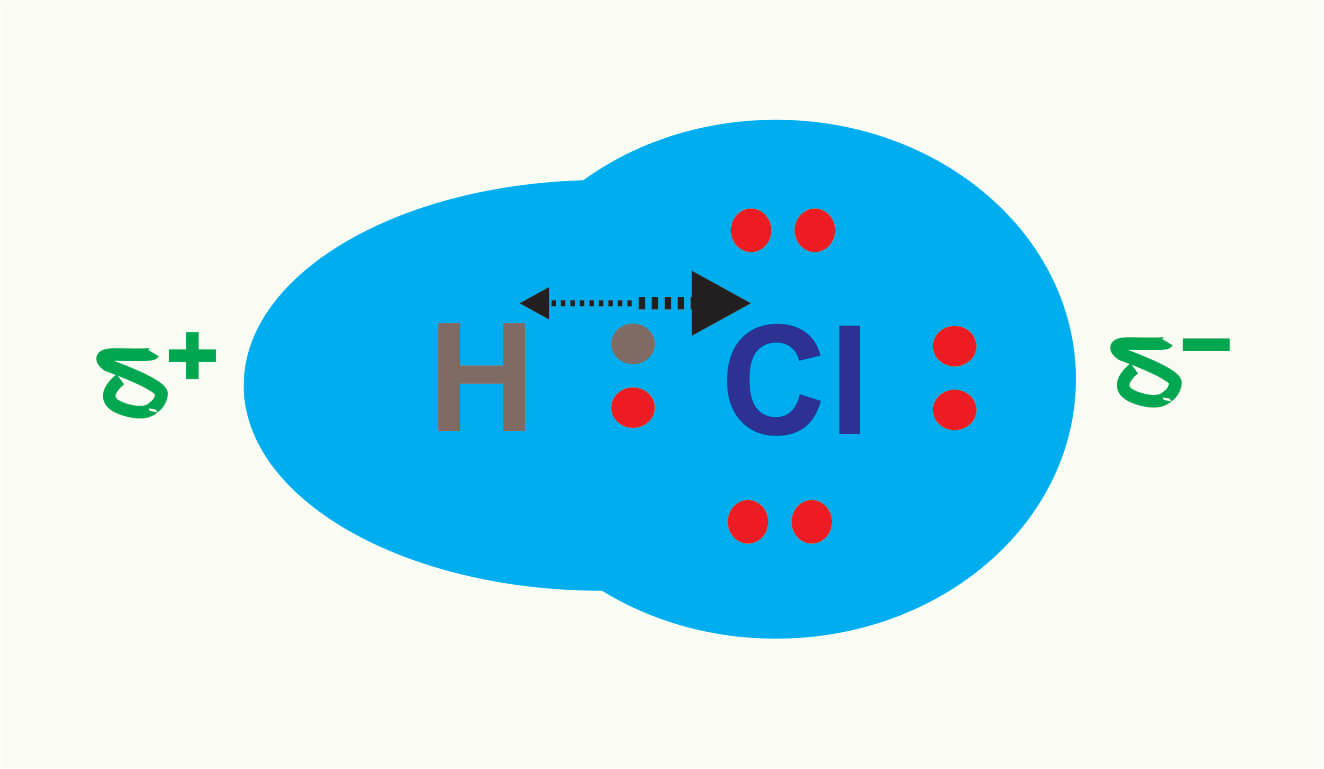
Hal ini dikenal dengan ikatan kovalen nonpolar. Pada contoh (b), pasangan elektron ikatan tertarik lebih dekat ke atom Cl karena Cl mempunyai daya tarik elektron lebih besar daripada H. Hal ini menyebabkan adanya polarisasi pada HCl, di mana atom Cl lebih negatif daripada atom H. Ikatan seperti ini dikenal dengan ikatan kovalen polar.
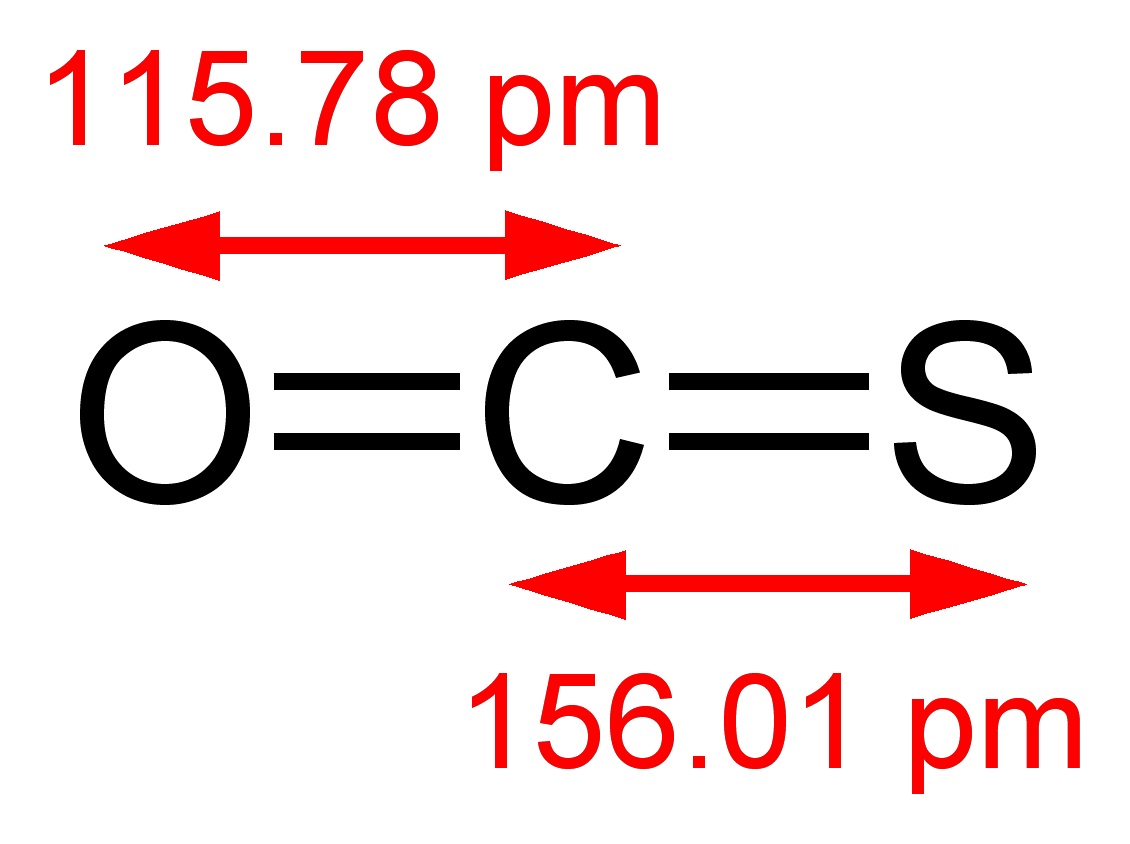
10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
Adapun contoh ikatan kovalen rangkap tiga adalah C 2 N 2 , CO, dan N 2. Agar lebih jelas, yuk simak pembahasan berikut mengenai ikatan kovalen rangkap tiga.. Ikatan kovalen non polar adalah ikatan yang terbentuk ketika pasangan elektron yang digunakan bersama-sama dari atom yang sama memiliki keelektronegatifan yang sama-sama kuat sehingga.
Contoh Senyawa Kovalen Polar
Ikatan kovalen juga mencakup beberapa macam interaksi, seperti ikatan σ, ikatan π, ikatan logam-ke-logam, interaksi agostik, ikatan bengkok, ikatan tiga pusat dua elektron (3c-2e), dan tiga pusat empat. ikatan-elektron (3c-4e). Berikut adalah beberapa contoh ikatan kovalen dalam kehidupan sehari-hari.
Contoh Senyawa Kovalen Polar
Molekul air adalah contoh penting dari ikatan kovalen polar yang menghasilkan momen dipol yang signifikan. 2. Metana (CH4) Metana adalah molekul yang terdiri dari satu atom karbon (C) dan empat atom hidrogen (H) yang terikat secara kovalen. Setiap atom hidrogen berbagi pasangan elektron dengan atom karbon melalui ikatan kovalen nonpolar.

10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
Perbedaan keelektronegatifan Atom-atom dalam senyawa kovalen menyebabkan terjadinya kutub positif dan negatif dalam senyawanya sehingga membentuk ikatan kova.

Contoh Senyawa Ion Dan Senyawa Kovalen Polar Merupakan Senyawa Ion My XXX Hot Girl
Contoh senyawa kovalen polar meliputi air (H2O), amonia (NH3), dan asam klorida (HCl) serta alkohol. Berikut ini adalah beberapa contoh dari senyawa kovalen polar beserta dengan ikatan dan elektronegativitasnya selengkapnya. 1.Air (H2O) Ikatan: O-H. Elektronegativitas: O = 3.44, H = 2.2.

Contoh Senyawa Kovalen Polar Format Soal
A. Ikatan Kovalen Polar Ikatan kovalen polar adalah ikatan kovalen yang mengalami pengkutuban atau polarisasi yang disebabkan karena kepadatan elektron berkumpul di sekitar atom yang memiliki keelektronegatifan tinggi dan menjadikannya lebih negatif dari bagian lain. Contoh ikatan kovalen polar yaitu: 1. Ikatan Kovalen Polar H2O (Air) 2. Ikatan Kovalen Polar HCl (Asam klorida) 3.

TRIK MENENTUKAN IKATAN KOVALEN POLAR KIMIA OKE PINTAR
Perbedaan anatar molekul polar dan nonpolar ditentukan oleh vektor muatan parsial yang dihasilkan dari setiap ikatan; Baca juga: Cara Menentukan Bentuk Molekul Senyawa SO3 . Contoh senyawa polar . Molekul polar mengandung ikatan ionik atau kovalen polar, berikut contoh-contohnya: Air (H2O) Amonia (NH3) Sulfur Dioksida (SO2) Hidrogen Sulfida (H2S)
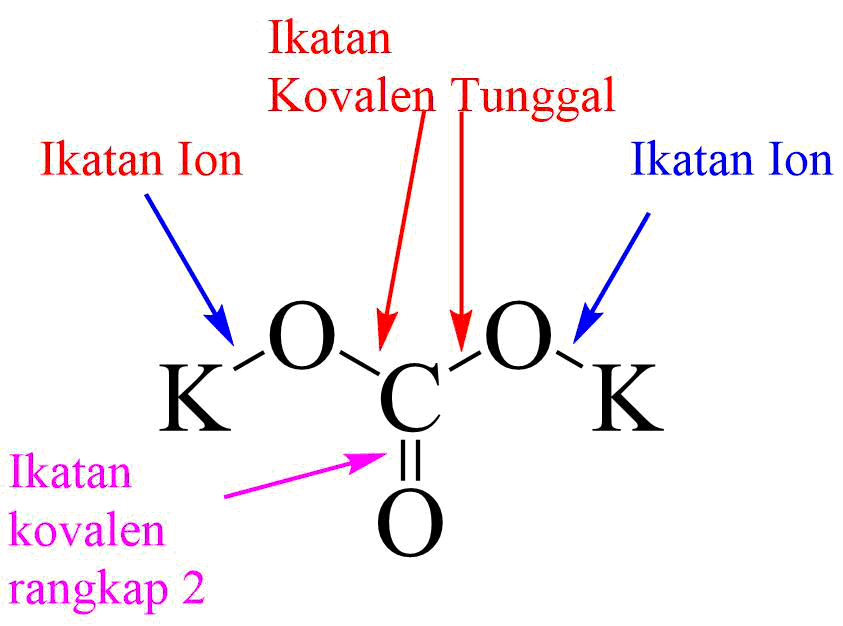
pengertian senyawa ion dan senyawa kovalen polar Matt Jackson
What is a polar covalent bond? A polar covalent bond occurs when atoms are shared unequally in a covalent bond. Specifically, when the difference in electronegativities of the two atoms in the bond is between 0.4 and 1.7. The terms polar bond and polar covalent bond are generally used interchangeably.
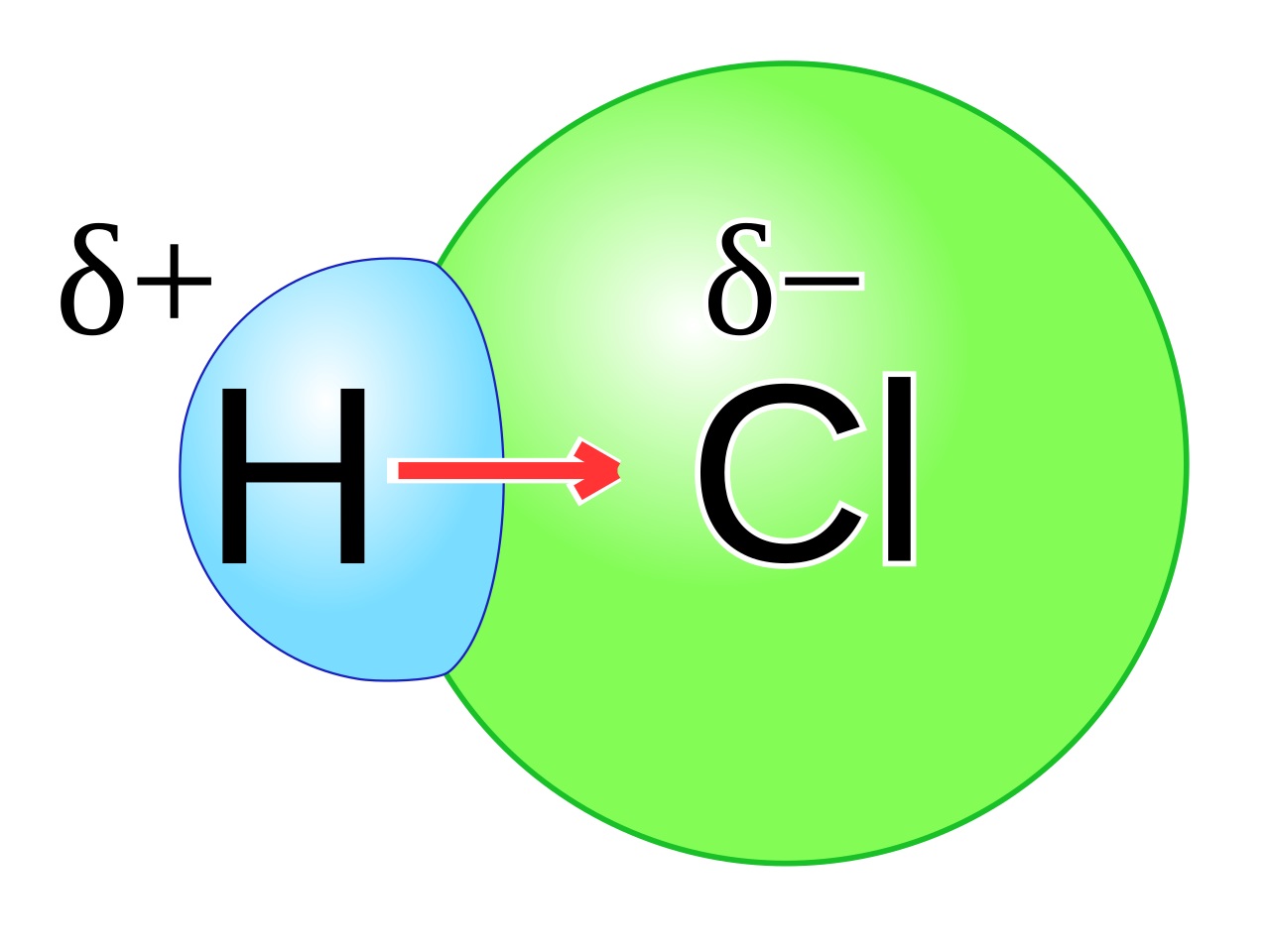
10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
Kalau ikatan kovalen nonpolar, pasangan elektron ikatannya akan sama kuat ke semua atom, di mana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak. Nah, itu dia jenis-jenis ikatan kovalen.
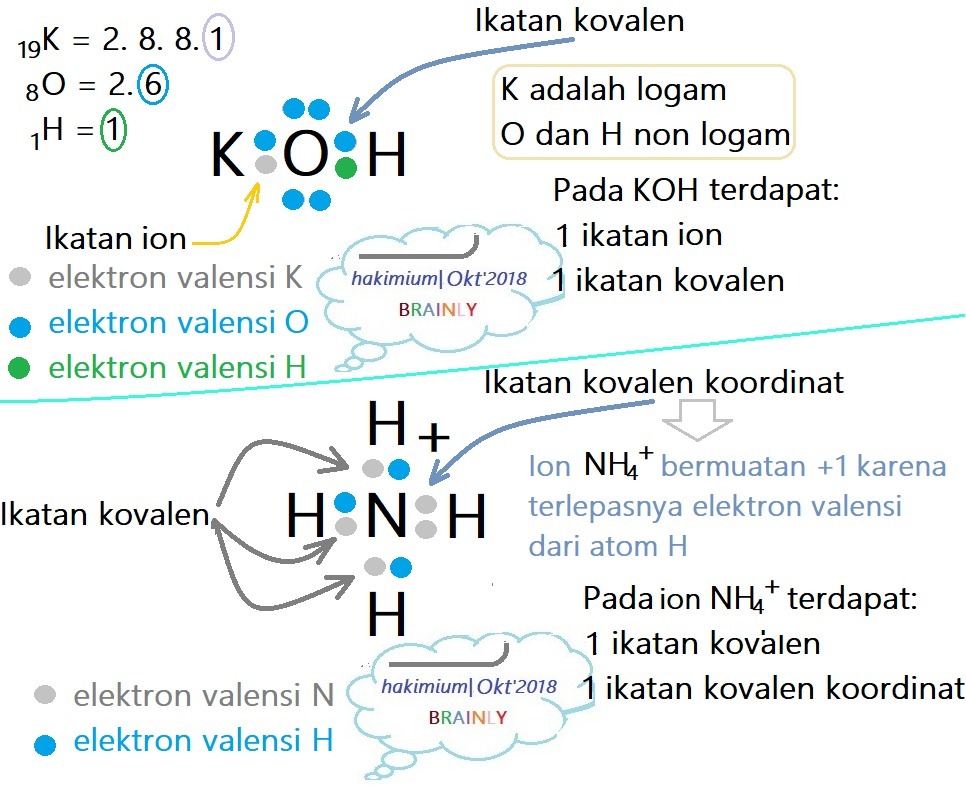
10 Contoh Soal Dan Pembahasan Ikatan Kovalen Polar Dan Nonpolar Materi Kimia Riset
Ikatan kovalen polar adalah ikatan kovalen yang terbentuk antara atom-atom yang memiliki perbedaan elektronegativitas. Contoh ikatan kovalen polar adalah senyawa HF. Atom H memiliki elektronegativitas 2,20. dan atom F memiliki elektronegativitas 3,98. Artinya terdapat perbedaan elektronegativitas sebesar 1,78.