
Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
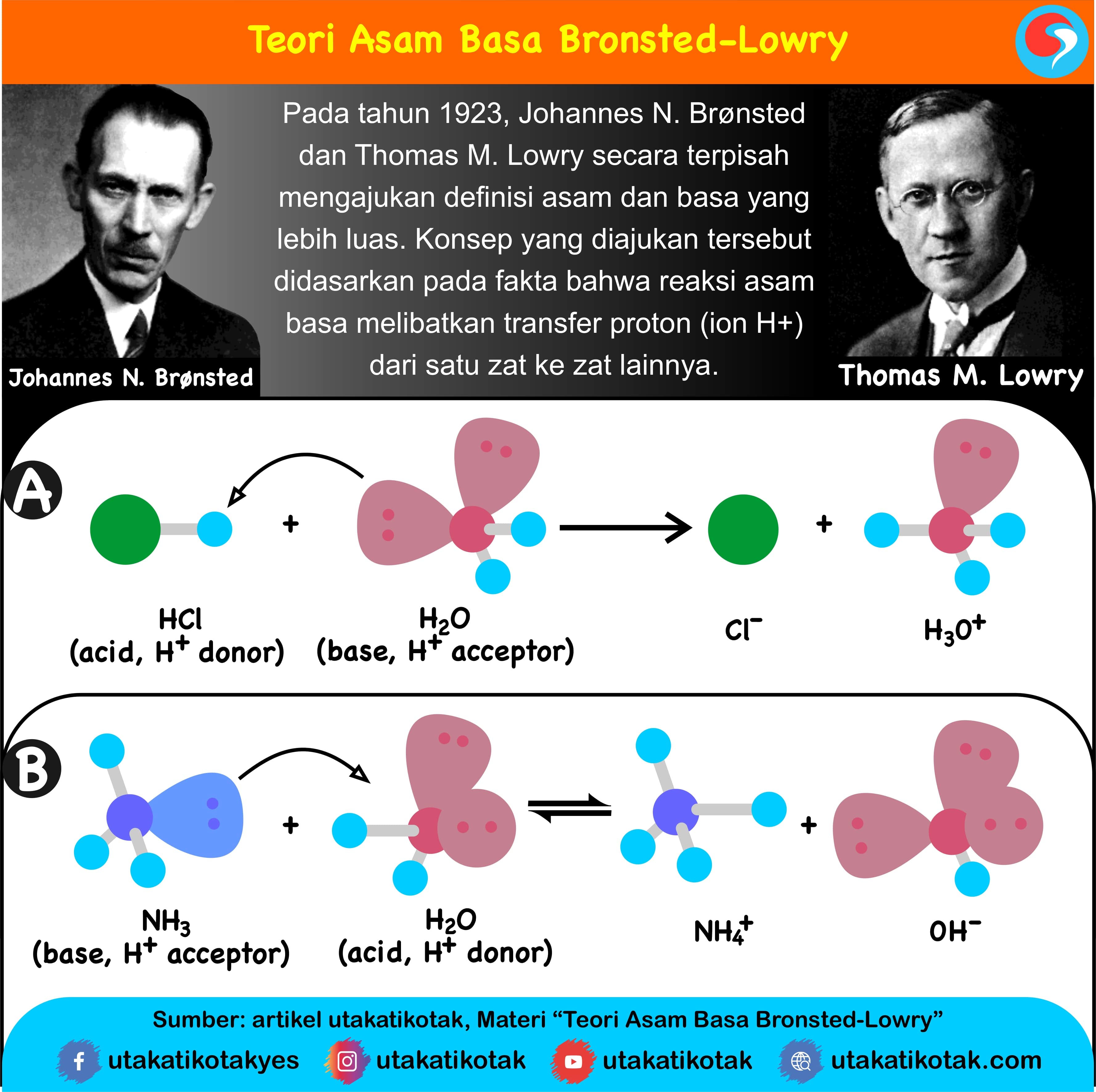
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).

Perhatikan Reaksi Asam Basa Konjugasi Menurut Bronsted Lo My XXX Hot Girl
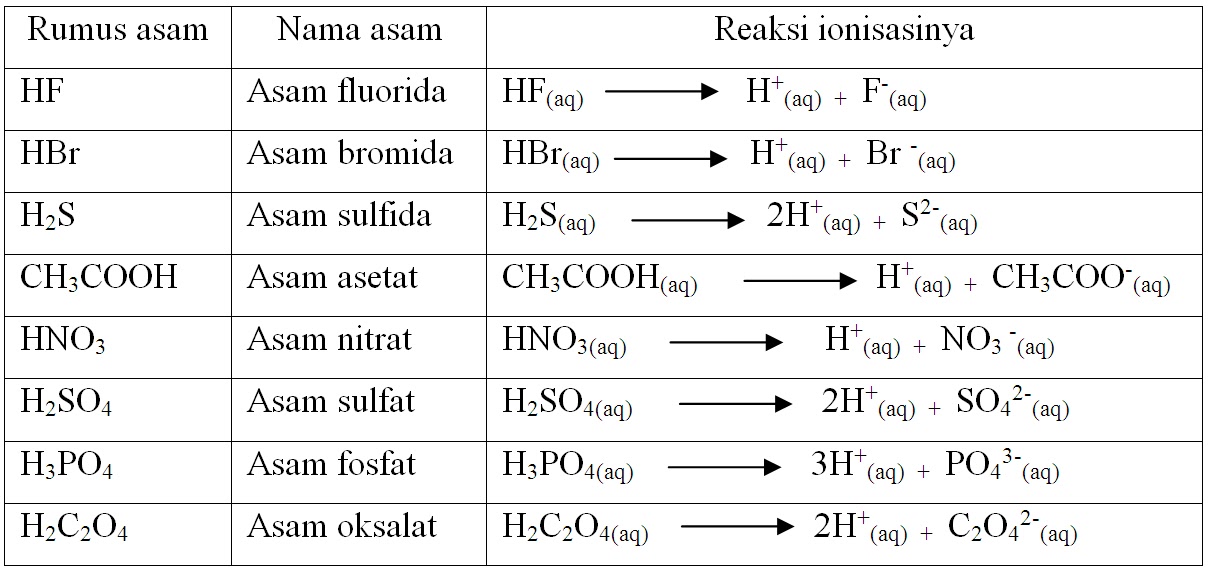
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
KOMPAS.com - Menurut teori Bronsted Lowry, asam adalah spesies yang dapat mendonorkan proton.Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry!. Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya.. Artinya, asam melepaskan proton (H+) untuk mencapai.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
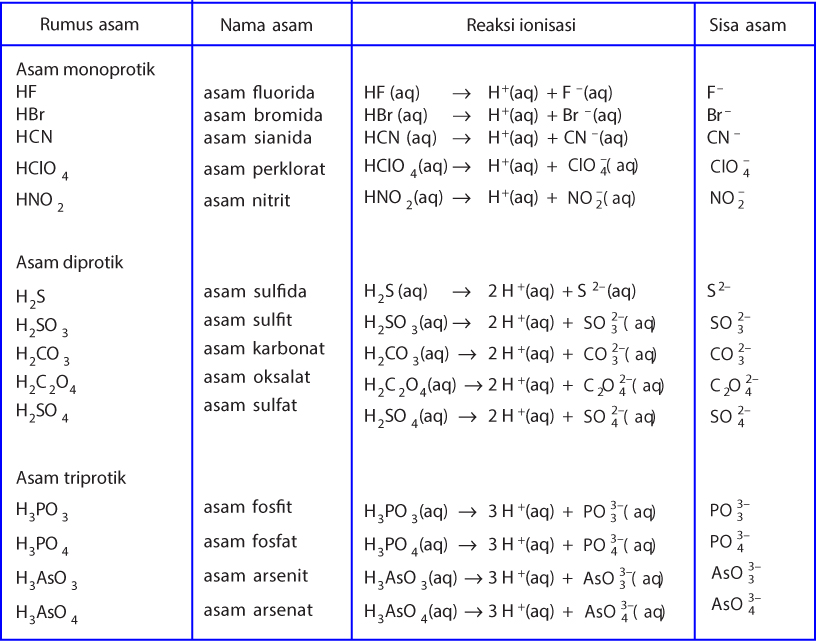
Contoh Mengidentifikasi Asam dan Basa Bronsted Lowry. Tidak seperti asam dan basa Arrehenius, pasangan asam basa Bronsted Lowry bisa terbentuk tanpa adanya reaksi di dalam larutan berair. Sebagai contoh, amonia dan juga hidrogen klorida bisa bereaksi membentuk amonium klorida padat menurut beberapa reaksi seperti berikut: NH3(g) + HCl(g) →.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.
Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Basa Bronsted Lowry
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
Konsep mudah belajar teori asam basa Bronsted-Lowry . dimana asam adalah pemberi proton . sedangkan Basa adalah penerima proton. terdiri dari asam basa konj.

Mudah😆 !! Pasangan AsamBasa menurut Teori Bronsted Lowry YouTube
Contoh Asam dan Basa Menurut Teori Bronsted-Lowry Beberapa contoh asam yang umum dikenal dalam teori Bronsted-Lowry antara lain asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). Sedangkan contoh basa meliputi amonia (NH3), natrium hidroksida (NaOH), dan kalium hidroksida (KOH).
Teori Asam dan Basa Menurut BronstedLowry
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Menentukan Asam Basa Konjugat BronstedLowry YouTube
50. Rangkuman 1 Teori Asam-Basa Bronsted-Lowry. Rangkuman 2 Teori Asam-Basa Bronsted-Lowry. Rangkuman 3 Teori Asam-Basa Bronsted-Lowry. Kuis Akhir Teori Asam-Basa Bronsted-Lowry. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru.

Teori Asam Basa Bronsted Lowry YouTube
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Teori Asam Basa Menurut Bronsted-Lowry Bronsted-Lowry mendeskripsikan asam dan basa dengan jenis larutan yang bermacam-macam. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor proton), sedangkan basa menerima H+ (akseptor proton).. Contoh Soal Asam Basa dan Jawaban, Materi IPA Kelas 7. Materi Asam-Basa: Pengertian, Ciri-Ciri.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Teori Asam Basa Menurut Bronsted-Lowry merupakan konsep penting dalam kimia yang menjelaskan bagaimana reaksi asam-basa terjadi. Menurut teori ini, asam. Langsung ke isi. Kimia. Menu.. Sebutkan contoh asam yang dihasilkan dari basa konjugat NH4+. Asam konjugat dari NH4+ adalah asam amonium (NH4+).