
Tugas Kimia Dasar Asam Basa Konjugasi UR Studocu
2. Konstanta Disosiasi Asam: Pasangan asam basa konjugasi memiliki nilai konstanta disosiasi asam (Ka) yang berbeda. Ka menyatakan sejauh mana asam akan melepaskan protonnya dalam larutan. Semakin besar nilai Ka, semakin kuat asam tersebut. Sebagai contoh, asam asetat (CH3COOH) memiliki basa konjugasi asetat (CH3COO-) dengan Ka yang lebih kecil.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Pasangan asambasa konjugasi dari reaksi NH3(aq)+H2O(l)
1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa Brønsted-Lowry . Perhatikan persamaan pelarutan asam nitrat dalam air berikut.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Trik Menentukan Pasangan Asam Basa Konjugasi KIMIA OKE PINTAR
Contoh Basa Konjugasi. Reaksi kimia umum antara asam konjugasi dan basa konjugasi adalah: HX + H 2 O X + H 3 O +. Dalam reaksi asam-basa, Anda dapat mengenali basa konjugasi karena merupakan anion. Untuk asam klorida (HCl), reaksi ini menjadi: HCl + H 2 O Cl + H 3 O +. Di sini, anion klorida, Cl , adalah basa konjugasi.

Mana yang berfungsi sebagai asam, basa, asam konjugasi, d...
Bronsted Lowry juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang memperoleh ion hidrogen, sedangkan basa konjugasi adalah yang tersisa setelah asam memberikan proton dalam sebuah reaksi kimia.. Berikut ini contoh asam dan basa yang ada di sekitarmu: Asam. Jeruk yang mengandung C 6 H 8 O 7. Cuka yang mengandung CH 3.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Dengan kata lain, asam konjugasi adalah anggota asam, HX, dari sepasang senyawa yang berbeda satu sama lain dengan mendapatkan atau kehilangan proton. Asam konjugasi dapat melepaskan atau menyumbangkan proton. Basa konjugasi adalah nama yang diberikan untuk spesies yang tersisa setelah asam menyumbangkan protonnya.
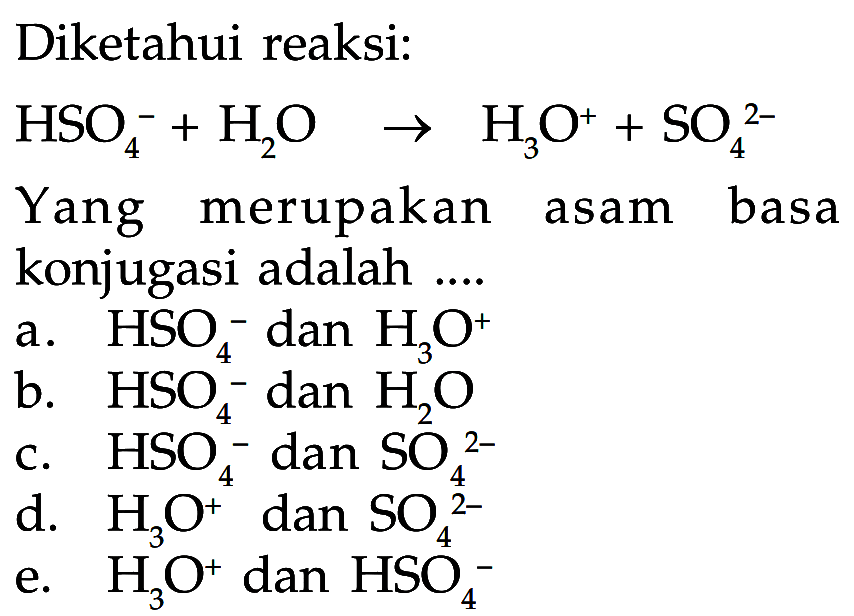
Senyawa berikut ini yang merupakan contoh asam poliprotik...
Berdasarkan teori asam basa Bronsted-Lowry, jika dalam suatu reaksi asam dan basa, apabila asam mendonorkan protonnya, maka akan dihasilkan spesies basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan spesies asam konjugasi. Nah, itulah yang dimaksud dengan pasangan asam dan basa konjugasi. Untuk lebih mudahnya, perhatikan 23 pasangan asam dan basa konjugasi berikut: No. Asam

Asam dan Basa Konjugasi
Baca Express tampilkan 1 Apa itu Asam Konjugasi? 2 Rumus Asam Konjugasi 3 Manfaat Rumus Asam Konjugasi 4 Contoh Penerapan Rumus Asam Konjugasi 5 Kesimpulan 5.1 Sampai jumpa kembali di artikel menarik lainnya! Hello Kaum Berotak! Kali ini kita akan membahas tentang rumus asam konjugasi yang sering digunakan dalam kimia. Mungkin bagi sebagian orang, istilah.

Asam basa konjugasi kimia SMA YouTube
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Konsep Asam Basa dalam bentuk pdf pada link dibawah ini: Modul Konsep Asam Basa; Kumpulan Soal Mudah, Sedang & Sukar. dan asam konjugasi yakni spesi dari basa yang telah mendapat proton. Dari teori ini diketahui beberapa asam yang bersifat diprotik (mampu melepas dua proton.

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
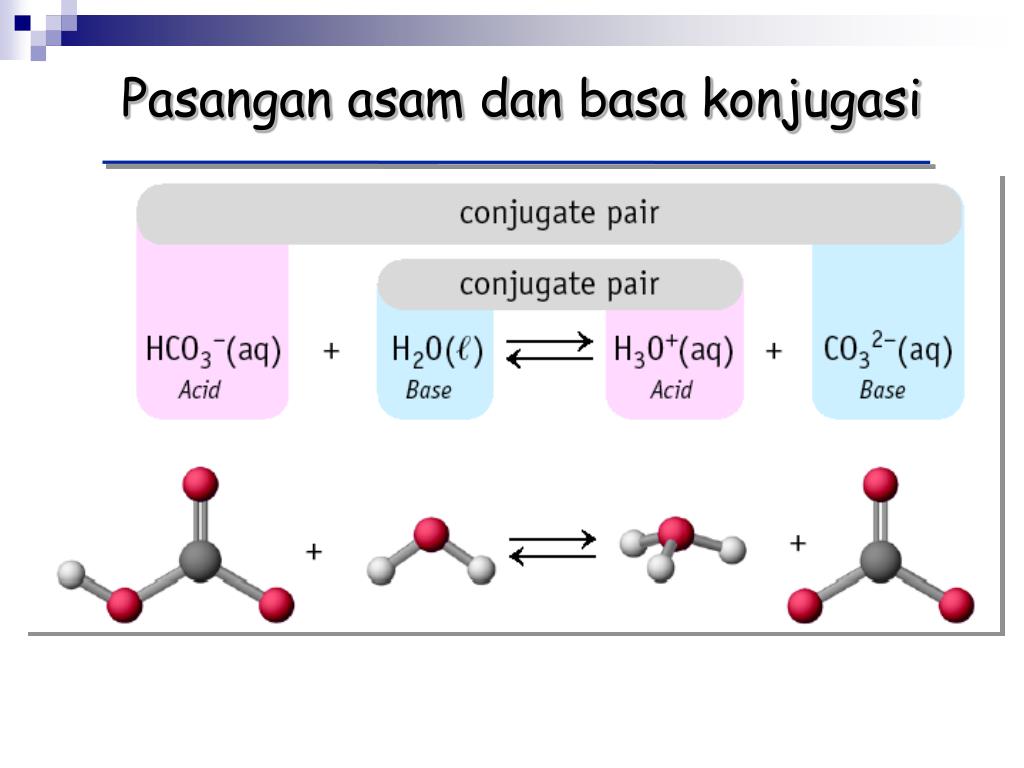
H 2 O adalah basa konjugasi dari H 3 O + dan H 3 O + adalah asam konjugasi dari H 2 O. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID4714427
KOMPAS.com - Menurut teori Bronsted Lowry, asam adalah spesies yang dapat mendonorkan proton.Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry!. Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya.. Artinya, asam melepaskan proton (H+) untuk mencapai.

Asam konjugasi soal kimia SMA YouTube
Asam basa konjugasi adalah zat dengan sifat asam dan zat dengan sifat basa dapat berpasangan. Berikut cara menentukan pasangan asam basa konjugasi. 10 Contoh Peristiwa Perubahan Energi yang Terjadi Sehari-hari. Skola. 07/03/2024, 10:00 WIB. Contoh Encoding dalam Komunikasi. Skola. 07/03/2024, 09:00 WIB. 5 Bedanya Perikanan Air Payau dan Air.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Jika basa konjugat lebih stabil dari asam, maka asam akan cenderung berdisosiasi dan menjadi lebih kuat, sedangkan jika sebaliknya maka akan menjadi asam lemah. Contoh asam:pasangan basa konjugasi. Berikut adalah beberapa contoh tambahan dari berbagai asam dan basa konjugatnya masing-masing: Asam klorida dan anion klorida (HCl dan Cl -)

Asam basa konjugasi soal kimia SMA YouTube
Teori-teori Asam Basa Menurut Para Ahli. Para ahli mengemukakan pendapatnya mengenai teori asam basa. Setiap ahli memiliki pandangan yang berbeda, sehingga menciptakan teori-teori asam basa. Berikut beberapa teori asam basa menurut para ahli. Kimia Dasar 2 Ed 3: Raymond Chang. 1.

Pengertian Konjugasi Dalam Ilmu Kimia Sains Kimia
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.