
SEL ELEKTROLISIS Kimia Kelas XII YouTube
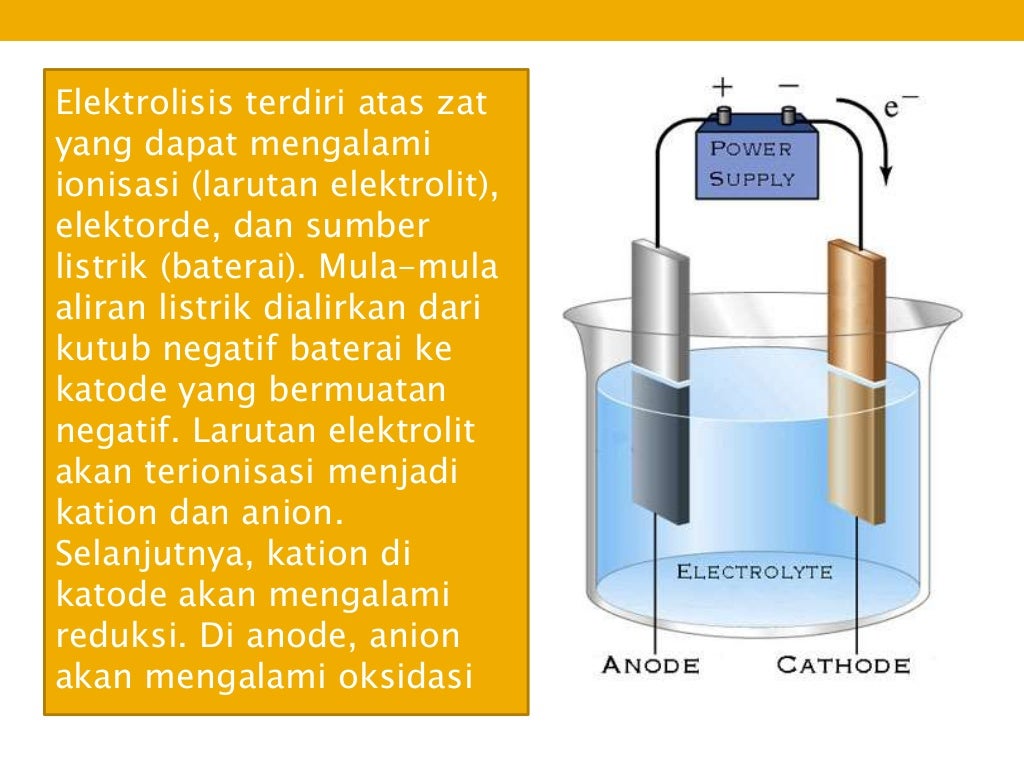
Secara teoritis, sel elektrolisis merupakan bagian dari sel elektrokimia, di mana energi listrik digunakan untuk menjalankan reaksi redoks tidak spontan. Secara umum, sel elektrolisis tersusun dari: - Elektrolit, yaitu zat yang dapat menghantarkan listrik. - Sumber listrik yang menyuplai arus searah ( Direct Current = DC), misalnya baterai.

Perhatikan diagram sel elektrolisis larutan KI berikut!e
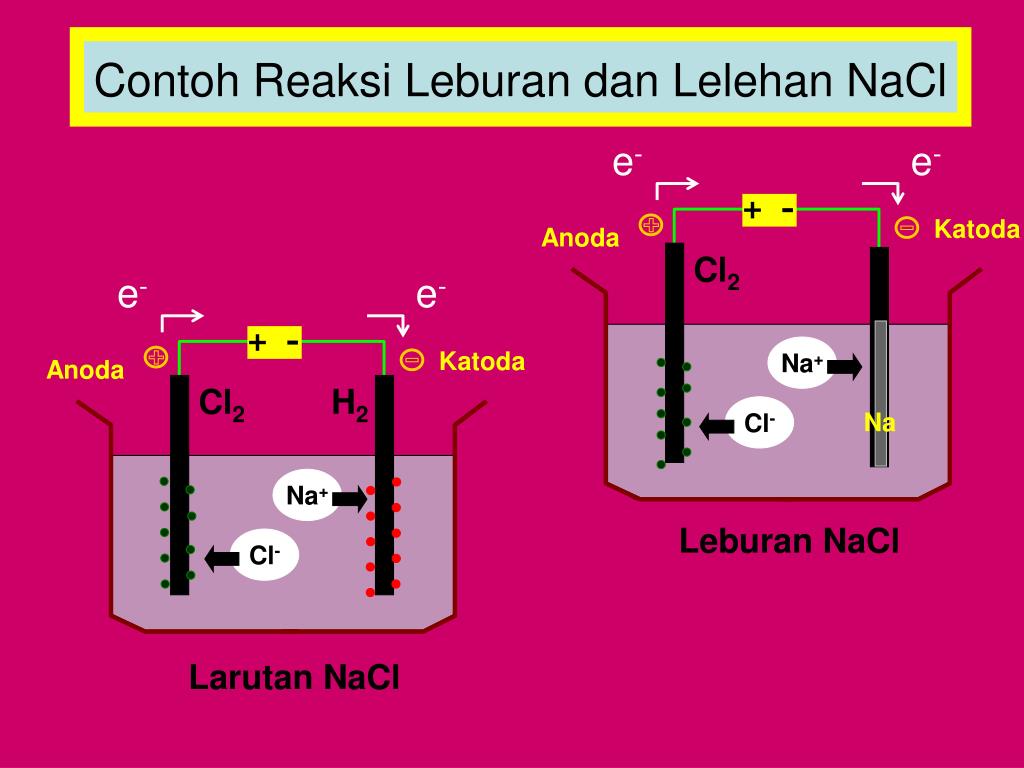
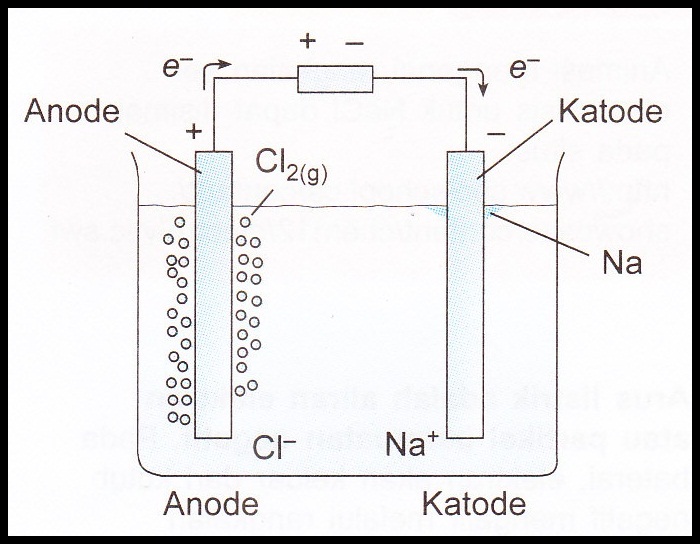
Ciri utama proses elektrolisis; ada ion bebas dalam larutan elektrolit, ada sumber arus DC dari luar, punya 2 elektroda (katoda dan anoda).. Pada sel elektrolisis, katoda berfungsi sebagai tempat berlangsungnya reaksi reduksi dan sebagai kutub negatif, sedangkan anoda merupakan tempat berlangsungnya reaksi oksidasi dan sebagai kutub positif..

Reaksi Sel Elektrolisis YouTube
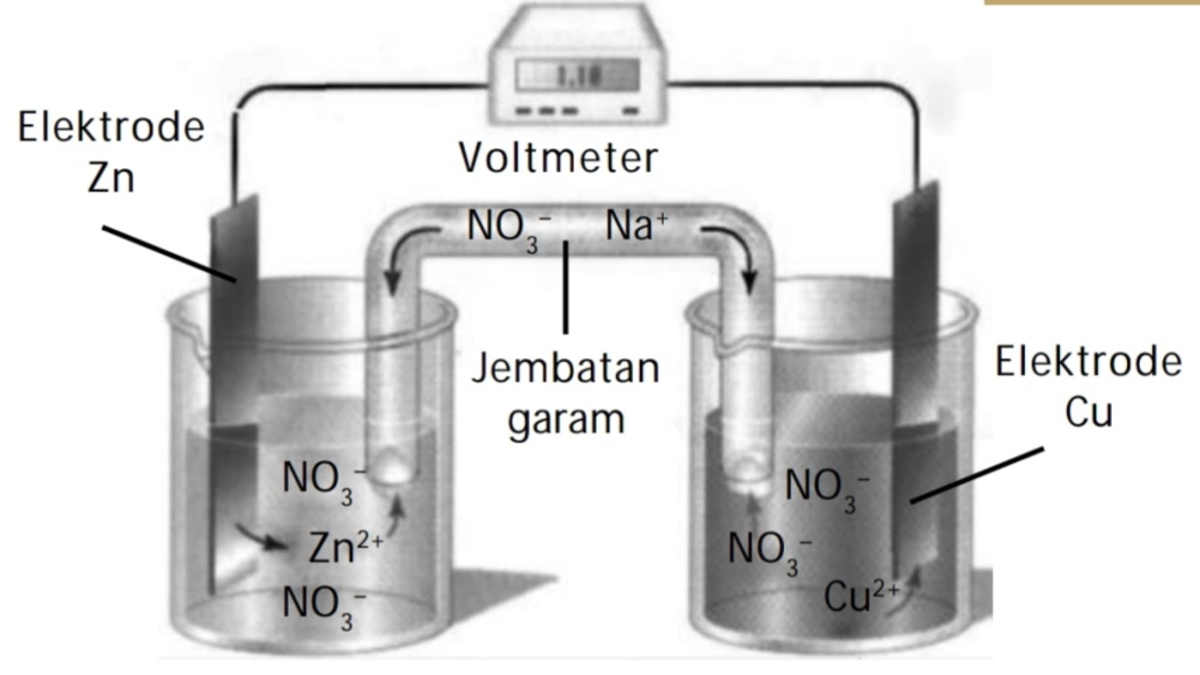
Prinsip Kerja Sel Elektrolis. Dilansir dari Encyclopaedia Britannica, sel elektrolisis memiliki dua elektroda yang bersifat negative dan positif dan dicelupkan kedalam larutan elektrolit yang mengandung ion-ion bermuatan.Kedua elektroda tersebut berada dalam wadah dan larutan elektrolit yang sama. Baca juga: Pengertian dan Prinsip Kerja Sel Volta Saat sel elektrolisis dialiri dengan listrik.
Perbedaan Sel Volta dan Sel Elektrolisis, Simak di Sini!
Adapun ciri-ciri dari Sel elektrolisis adalah mempunyai 3 komponen utama. Tiga komponen utama sel elektrolisis adalah: Katoda (yang bermuatan negatif untuk sel elektrolitik) Anoda (yang bermuatan positif untuk sel elektrolitik) Elektrolit. Elektrolit menyediakan media untuk pertukaran elektron antara katoda dan anoda.
Elektrolisis Beserta Soal dan Pembahasannya
Ciri Fisik Sel Elektrolisis. Ciri fisik sel elektrolisis menjadi salah satu hal penting yang perlu dipahami dalam proses elektrolisis. Sel elektrolisis umumnya terbuat dari bahan konduktif seperti tembaga atau platina yang dilapisi dengan lapisan logam yang akan direaksikan. Bahan konduktif ini memungkinkan aliran arus listrik melalui sel elektrolisis.

Sel elektrolisis
Baca juga: Pengertian, Prinsip Kerja dan Stoikiometri Sel Elektrolisis. Alat percobaan Volta kemudian dinamakan sel elektrokimia. Sel elektrokimia Volta menjadi baterai pertama yang memproduksi listrik dalam sejarah umat manusia. Sel elektrokimia terdiri dari dua buah elektroda konduktif, yaitu katoda dan anoda.
PPT Sel Elektrolisis PowerPoint Presentation, free download ID5483557
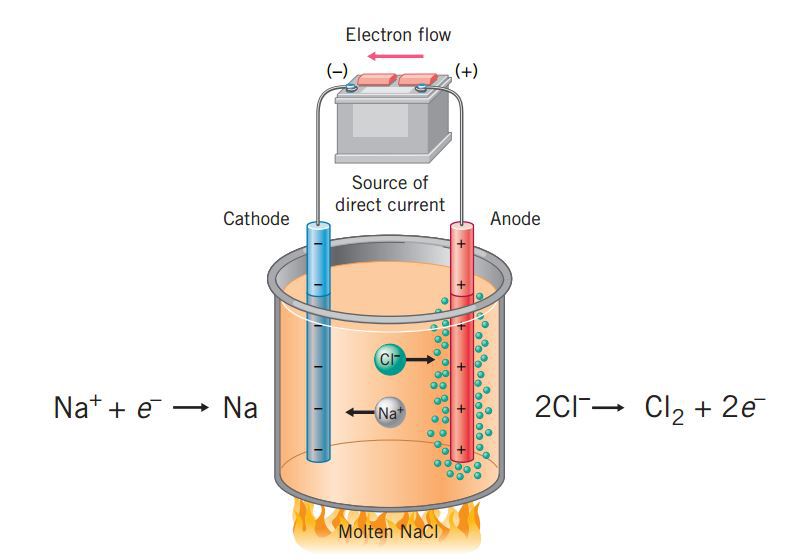
B. Prinsip Kerja Sel Elektrolisis. Sel elektrolisis mempunyai dua elektroda bersifat negatif dan positif. Cara kerja sel elektrolisis yaitu dengan menghubungkan sumber arah dari kutub negatif ke katode dan kutub positif ke anode. Kemudian terjadi over potential yang mendorong reaksi reduksi dan oksidasi non-spontan dapat berjalan.
Elektrokimia Sel Elektrolisis dan Hukum Faraday
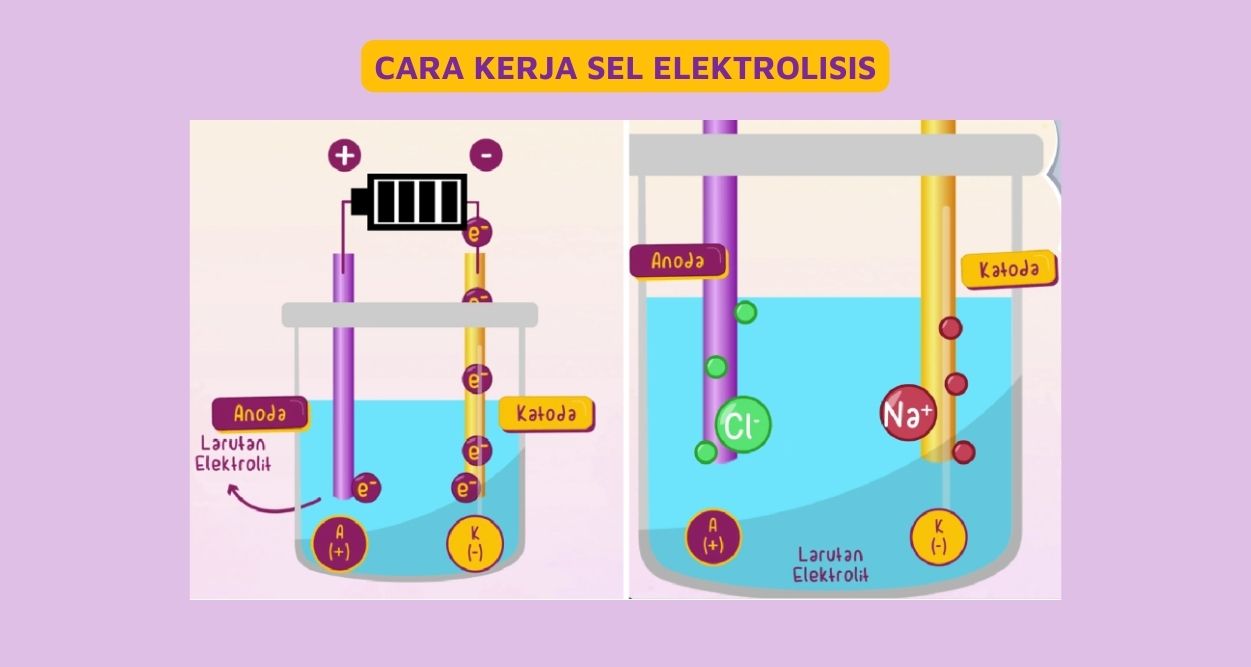
Sel Elektrolisis. Dalam sel elektrolisis, terdapat ciri-ciri utama, yaitu : Terdapat larutan elektrolit yang mengandung ion bebas, dimana salah satu komponen ionnya terkandung ion dari anoda. Ion-ion tersebut nantinya akan memberi atau menerima elektron yang akan mengalir melalui larutan elektrolit.

Sel elektrolisis
Ciri-Ciri Sel Elektrolisis. Berikut ini terdapat beberapa ciri-ciri dari sel elektrolisis, yakni sebagai berikut: Dalam senyawa terangkai dari setengah sel anoda (A) dan setengah dari katoda (K) Anoda ialah eletroda lokasi berlangsungnya hasil oksidasi, sementara katoda ialah elektroda berlangsungnya hasil reduksi;
Sel elektrolisis
Pengertian dan Ciri Sel Elektrolisis. Dilansir dari Mudah dan Aktif Belajar Kimia karangan Yayan Sunarya dkk (2007: 42), sel elektrolisis adalah penguraian suatu zat akibat adanya arus listrik. Zat yang terurai dapat berbentuk padat, cairan, atau larutan. Arus listrik yang digunakan adalah searah (DC). Terdapat tiga ciri utama suatu proses sel.
Sel Elektrolisis Pengertian, Reaksi, dan Contoh Soal
Elektrolisis adalah penguraian suatu elektrolit oleh arus listrik pada sel elektrolisis. Reaksi kimia akan terjadi jika arus listrik dialirkan melalui larutan elektrolit, yaitu energi listrik (arus listrik) diubah menjadi energi kimia (reaksi redoks). Tiga ciri utama, yaitu: Ada larutan elektrolit yang mengandung ion bebas.

Perbedaan sel volta dan sel elektrolisis 2021
Ciri sel elektrolisis selanjutnya adalah adanya anode dan katode yang bertindak sebagai terminal listrik. Anode berfungsi sebagai elektroda positif, sedangkan katode berfungsi sebagai elektroda negatif. Tidak lupa, ada elektrolit yang menjadi penghubung antara anode dan katode. Dalam elektrolit inilah reaksi kimia terjadi dengan bantuan arus.
Perhatikan gambar ilustrasi sel elektrolisis berik...
Elektrolisis adalah salah satu aplikasi dari sel elektrokimia, yang dapat dapat mengubah energi listrik menjadi reaksi kimia secara spontan. Elektrolisis umumnya digunakan untuk penyepuhan logam agar tidak mudah berkarat. Misalnya aplikasi ini untuk penyepuhan perak pada peralatan rumah tangga. Dalam proses penyepuhan, logam yang akan disepuh.
+%2B+n+é+X+(reduksi)+Anoda++Y(s)+Ym+%2B+%2B+m+é+(oksidasi)+atau++Zm+-(aq)+Z+%2B+m+é+(oksidasi)+(Instagram+Post)+(Presentation+(169)).png/c8fff1f8-30e6-7ba6-a46c-a453977effe7?imagePreview=1)
Sel Elektrolisis Pengertian, Proses Reaksi, dan Contohnya
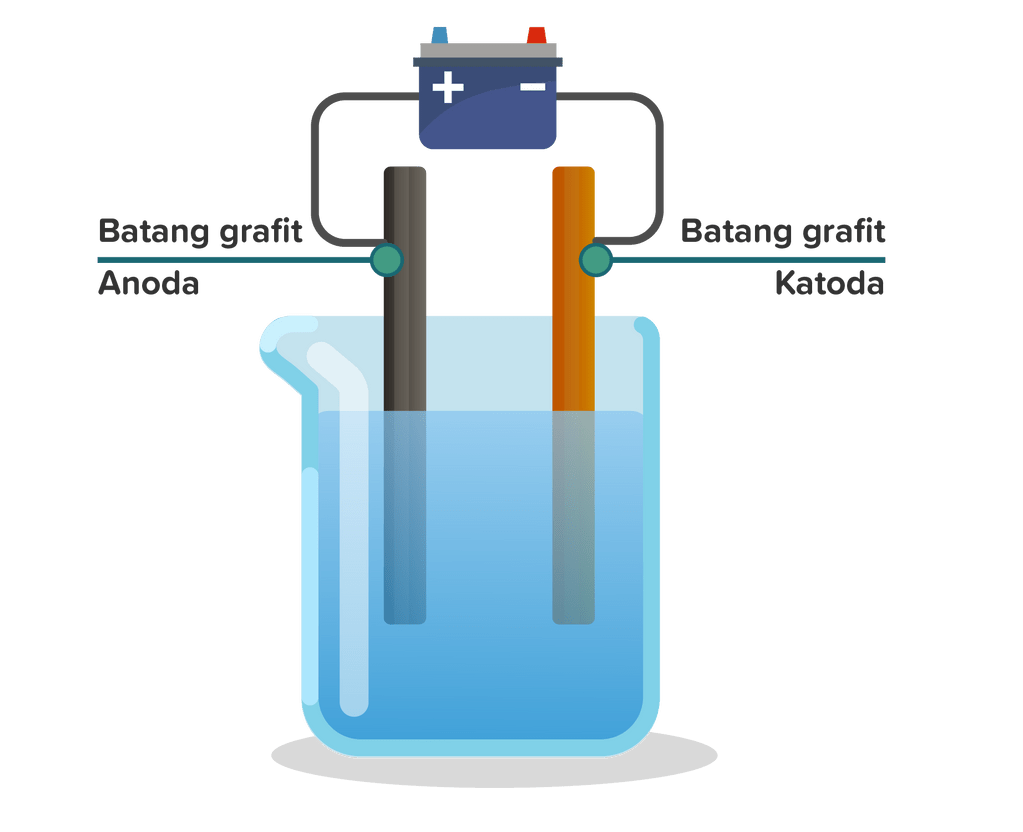
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.

Penggunaan Sel Elektrolisis Dalam Industri dan Kehidupan Seharihari
Contoh Soal Sel Elektrolisis dan Pembahasan. Tulislah reaksi elektrolisis berikut. a. CuSO 4 (aq) → Cu 2+ (aq) + SO 42− (aq) Cu tidak termasuk logam aktif, sehingga kation Cu 2+ akan tereduksi di katode. Oleh karena elektrode tembaga (Cu) tidak termasuk elektrode inert, maka anode Cu akan teroksidasi. b.

Contoh Soal Sel Elektrolisis
Jadi, sel elektrolisis merupakan reaksi yang melibatkan arus listrik untuk menjadi reaksi kimia.. Ciri-Ciri & Contohnya. Bagaimana Cara Kerja Sel Elektrolisis? Nah, cara kerjanya adalah dengan cara menyiapkan kompartemen yang berisi larutan elektrolit, kemudian dua buah elektroda dicelupkan pada larutan tersebut. Elektrodenya bernama.