
Sistem Buffer Asam Basa PDF
Larutan dapar atau Larutan penyangga (lebih tepatnya, dapar pH atau dapar ion hidrogen) (Inggris: buffer solution, pH buffer, hydrogen ion buffer ) adalah larutan yang mengandung campuran asam lemah dan basa konjugatnya, atau sebaliknya. Perubahan pH larutan ini sangat kecil, ketika asam atau basa kuat ditambahkan, dalam jumlah sedikit atau.

Asam Basa [Buffer Asam Basa] CEK DESKRIPSI YouTube
Penambahan basa (OH −): ion OH − dari asam yang ditambahkan akan bereaksi dengan komponen asam konjugasinya. Misal larutan buffer basa NH3 / NH + 4: NH3 + H + ⇄ NH + 4 NH + 4 + OH − → NH3 + H2O. -. pengenceran: pada pengenceran hanya memperbesar volume komponen-komponen larutan penyangga.

ASAMBASAGARAM p H buffer ASAM TEORI ASAM PROTON
TM dan laporan praktikum Kimia Dasar - materi buffer. Larutan penyangga atau sering disebut larutan buffer adalah larutan yang dapat mempertahankan pH pada kisarannya apabila terdapat upaya untuk menaikkan atau menurunkan pH, melalui penambahan air/asam/basa dalam jumlah yang besar. Larutan penyangga memiliki dua komponen yaitu asam dan basa.

Kekuatan asam basa, Buffer, dan Kesetimbangan YouTube
Bookshelf ID: NBK507807 PMID: 29939584. To maintain homeostasis, the human body employs many physiological adaptations. One of these is maintaining an acid-base balance. In the absence of pathological states, the pH of the human body ranges between 7.35 to 7.45, with the average at 7.40.

Larutan Penyangga (Larutan Buffer) AsamBasa dan Cara Memahami Rumusnya
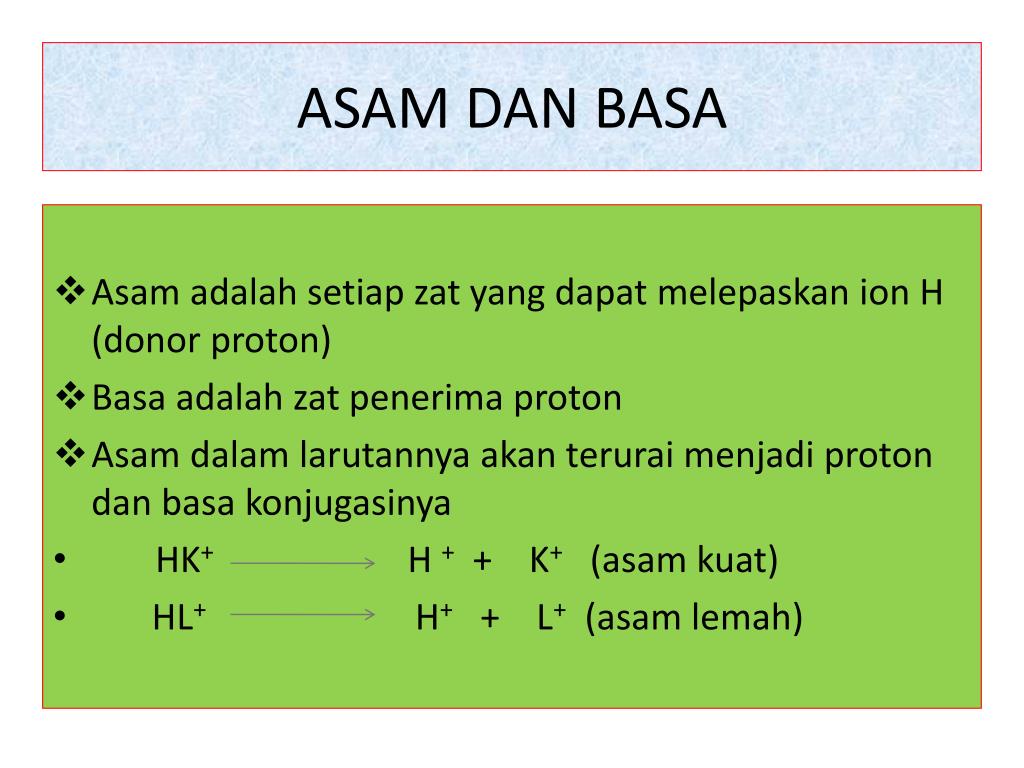
Sifat larutan buffer. a) Asam Lemah Dengan Basa Konjugasinya (Buffer Asam) Misalnya, kedalam campuran larutan CH 3 COOH dan CH 3 COO - ditambahkan sedikit asam atau basa, yang terjadi adalah sebagai berikut. Jika ditambahkan asam maka ion H + dari asam akan bereaksi dengan ion CH 3 COO - membentuk CH 3 COOH menurut reaksi: CH 3 COO - (aq.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation ID6420439
Buffer asam memiliki pH kurang dari 7 dan terbentuk dari asam lemah dengan garamnya. Sedangkan buffer basa memiliki pH lebih dari 7 dan terbuat dari basa lemah dengan garamnya. Larutan buffer bekerja dengan menghilangkan ion hidrogen (H +) ataupun ion hidroksida (OH -) untuk mencegah perubahab pH. Larutan buffer asam dan buffer basa bekerja.
PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Example 11.8.1. Which solute combinations can make a buffer solution? Assume all are aqueous solutions. HCHO 2 and NaCHO 2; HCl and NaCl; CH 3 NH 2 and CH 3 NH 3 Cl; NH 3 and NaOH; SOLUTION. Formic acid (HCHO 2) is a weak acid, while NaCHO 2 is the salt made from the anion of the weak acid—the formate ion (CHO 2 −).The combination of these two solutes would make a buffer solution.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Larutan buffer asam mempertahankan pH pada suasana asam (pH < 7). Larutan buffer asam terdiri dari komponen asam lemah (HA) dan basa konjugasinya (A−). Larutan seperti ini dapat diperoleh dengan: mencampurkan asam lemah (HA) dengan garam basa konjugasinya (LA, yang dapat terionisasi menghasilkan ion A−)

Cara Kerja Larutan Penyangga Asam dan Basa Kimia SMA Kelas 11 Materi
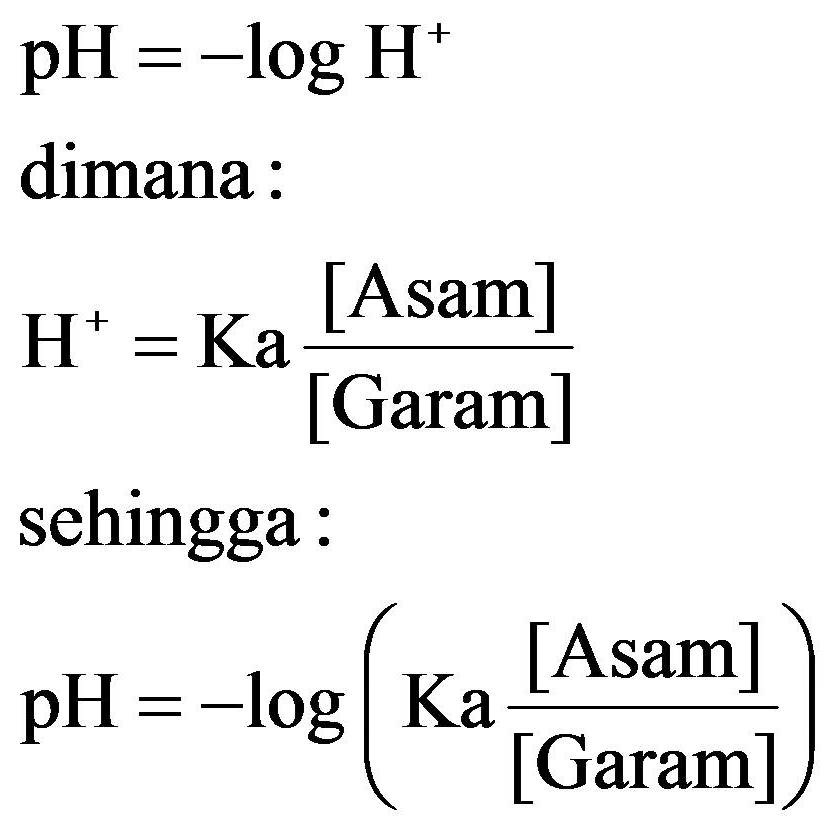
pH Larutan Penyangga Larutan penyangga asam. Dalam larutan buffer asam yang mengandung CH 3 COOH dan CH 3 COO −, terdapat kesetimbangan:. CH 3 COOH(aq) ⇌ CH 3 COO − (aq) + H + (aq). Setelah disusun ulang, persamaan pH larutan di atas akan menjadi persamaan larutan penyangga yang dikenal sebagai persamaan Henderson - Hasselbalch sebagaimana persamaan berikut ini:
PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
BAB VI KESIMPULAN 6.1 Kesimpulan Buffer merupakan larutan yang cenderung mempertahankan pH nya, namun buffer sendiri memiliki kapasitas tertentu dimana jika ditambahkan sejumlah asam atau basa kuat akan merubah pH buffer itu sendiri. Semakin ditambah asam dan basanya, maka pH nya semakin berubah menurut tingkat pH pentitrasinya.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Maka kapasitas buffer yang dimiliki ini termasuk kecil. penambahan basa atau asam pada suatu larutan buffer memang dapat mengubah nilai pH-nya. Namun perubahan itu tidak begitu besar dan bisa diabaikan. Akan tetapi apabila jumlah asam maupun basa yang ditambahkan semakin banyak, maka perubahan pH yang terjadi tidak boleh diabaikan.
Cara Menghitung pH Larutan Asam, Basa, Garam Beserta Contoh Soal dan
Berdasarkan asam basa penyusunnya, larutan buffer dibedakan menjadi 2, yakni sebagai berikut : 1. Larutan buffer asam. Larutan buffer asam yaitu larutan penyangga yang terbentuk dari asam lemah dan basa konjugasinya. Larutan penyangga asam mempunyai pH kurang dari 7. Contoh: CH₃COOH (asam lemah) dan CH₃COO- (basa konjugasinya). 2.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
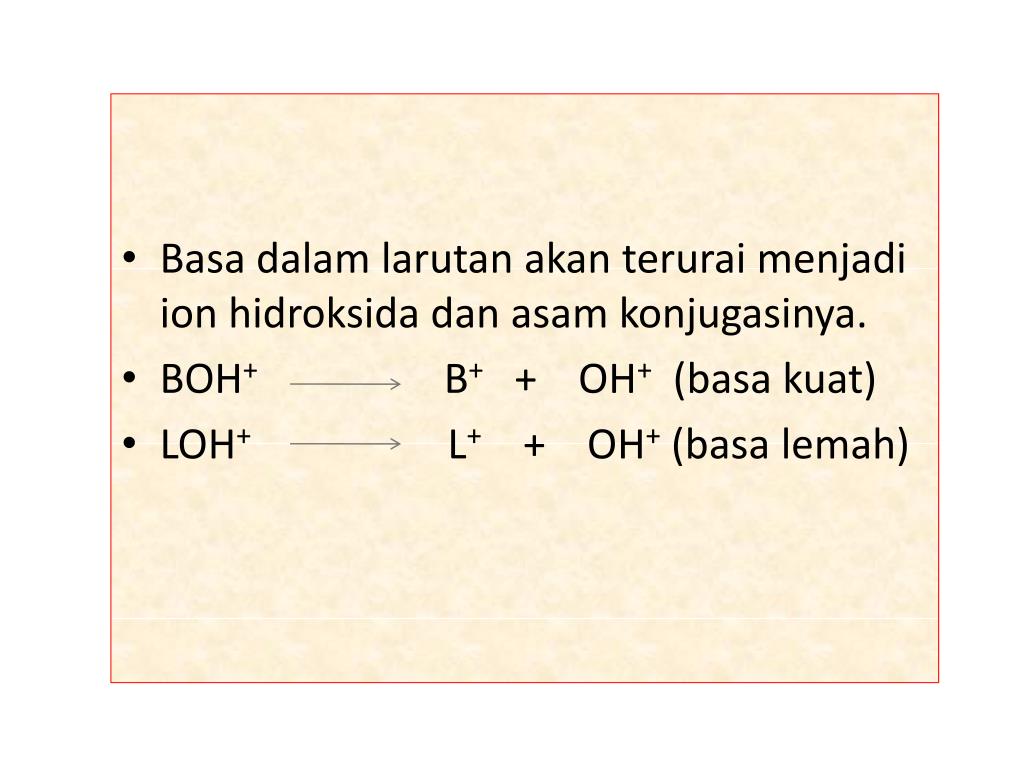
Untuk larutan asam, pH-nya ini berada di angka 7 yang dibuat dari asam lemah seperti CH₃C00H, HCN, H₂C0₃, dan ditambahkan basa konjugasi. Jadi, meskipun namanya larutan asam, tapi tetap nih ada sifat basanya juga. Larutan Penyangga Basa. Nah, kalau untuk larutan basa, harus ada campuran antara basa lemah seperti NH₃ dan asam konjugasinya.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download
Cara kedua ini harus menghasilkan sisa dari asam lemah atau basa lemah. Dari persamaan tersebut, CH 3 COOH (asam lemah) dan NH 3 (basa lemah) masih tersisa, sedangkan NaOH dan HCl habis bereaksi.. Jadi, garam yang terbentuk dari CH 3 COONa mengandung basa konjugasi. Sedangkan garam dari NH 4 Cl mengandung asam konjugasi.. Jenis-Jenis Larutan Buffer dan Cara Kerjanya

Mengenal buffer dalam sel (Pasangan asambasa konjugasi H2PO4 dan
Larutan buffer asam atau larutan penyangga asam bertugas mempertahankan pH dalam kondisi asam yakni pH<7. Larutan penyangga asam tersusun dari komponen basa konjugasi (A-) dan asam lemah (HA). Larutan penyangga basa bisa diperoleh melalui: Mencampurkan HA atau asam lemah dan garam basa konjugasinya LA dimana bisa terionisasi dan menghasilkan.

Penyangga Buffer Asam Asetat dan Natrium Asetat YouTube
Buffer juga dapat disebut buffer pH, buffer ion hidrogen, atau larutan buffer. Buffer digunakan untuk mempertahankan pH yang stabil dalam larutan, karena dapat menetralkan sejumlah kecil asam basa tambahan. Untuk larutan buffer yang diberikan, terdapat rentang pH kerja dan sejumlah asam atau basa tertentu yang dapat dinetralkan sebelum pH berubah.