
Reaksi Redoks2 Penyetaraan Reaksi Cara PBO/Biloks & Pembahasan Soal YouTube
Bilangan oksidasi. Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik. Bilangan ini menggambarkan tingkat oksidasi (kehilangan elektron) dari sebuah atom dalam senyawa kimia. Secara konseptual, bilangan oksidasi dapat berupa bilangan.

3 Contoh Soal Bilangan Oksidasi (Biloks) YouTube
Postingan ini membahas contoh soal bilangan oksidasi atau biloks dan pembahasannya / penyelesaiannya. Bilangan oksidasi adalah nilai muatan atom dalam sebuah senyawa atau ion. Ketentuan dalam menentukan biloks sebagai berikut: Atom unsur bebas seperti O2, N2, Fe dan lainnya mempunyai biloks = 0.Atom logam golongan IA (Li, Na, K, Rb, Cs) mempunyai biloks = +1.Atom

Cara Menentukan Biloks Berdasarkan Prioritas YouTube
Agar jumlah biloks H dan O sama dengan 0, maka biloks O harus bernilai -2. Unsur golongan logam (IA, IIA, IIIA) memiliki biloks = positif sesuai golongannya; Biloks golongan IA = H, Li, Na, K, Rb, Cs, Fr = +1. Contoh: Bilangan oksidasi Na dalam senyawa NaCl adalah +1. Biloks golongan IIA = Be, Mg, Ca, Sr, Ba, Ra = +2.

PPT Reaksi Redoks PowerPoint Presentation, free download ID7436241
Bilangan oksidasi atau yang disingkat dengan nama Biloks merupakan istilah kimia, berdefinisi sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menunjukkan jumlah elektron yang telah diterima atau diserahkan ke atom lain.Beberapa atom hanya mempunyai satu biloks, namun ada beberapa atom yang mempunyai lebih dari satu biloks.

PENENTUAN BILANGAN OKSIDASI (BILOKS). YouTube
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.

Konsep mudah menentukan biloks Kimia SMA YouTube
Biloks atau bilangan oksidasi suatu unsur adalah bilangan yang menunjukkan sumbangan muatan suatu atom unsur pada molekul atau ion yang dibentuknya. Bilangan oksidasi sering disingkat dengan b.o. Bilangan oksidasi suatu unsur pada suatu senyawa umumnya sama dengan jumlah elektron yang dilepas atau dipasangkan oleh satu atom unsur pada senyawa.

PENYETARAAN REAKSI REDOKS DENGAN CARA BILOKS UNTUK REAKSI MOLEKUL (Part 2) YouTube
Jumlah Biloks Ion Poliatomik → Biloks = Muatannya. Contoh: (SO4) 2-(1 x biloks S) + (4 x biloks O) = -2. Biloks Hidrogen. Jika hidrogen berikatan dengan logam, maka biloks = -1; Contoh: NaH, hidrogen lebih elektronegatif daripada Na, sehingga hidrogen akan menarik elektron dan Na melepaskan elektron. Maka, H bermuatan negatif dan Na bermuatan.

biloks Cu biloks kimia kelas X YouTube
Bilangan oksidasi atau Biloks adalah jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menunjukkan jumlah elektron yang telah diterima atau diserahkan ke atom lain.. (Li, Na, K, Rb, Cs, Fr), Biloksnya adalah +1. Biloks K dalam KCl, KNO3, atau K2SO4 bernilai = +1; Pada nsur logam golongan 2 (sistem lama golongan. IIA.

Perlukah Menghafal Aturan Bilangan Oksidasi? Urip dot Info
Biloks H = +1. Atom H memiliki indeks 4, maka biloks H dikalikan dengan indeks H = +4. Karena jumlah muatan NH₄+ = +1, maka biloks N haruslah -3, agar ketika biloks N dan H dijumlahkan, hasilnya sesuai dengan jumlah muatannya, yaitu +1. 8. Bilangan oksidasi oksigen (O) dalam senyawa peroksida = -1. Bilangan oksidasi O dalam senyawa non.
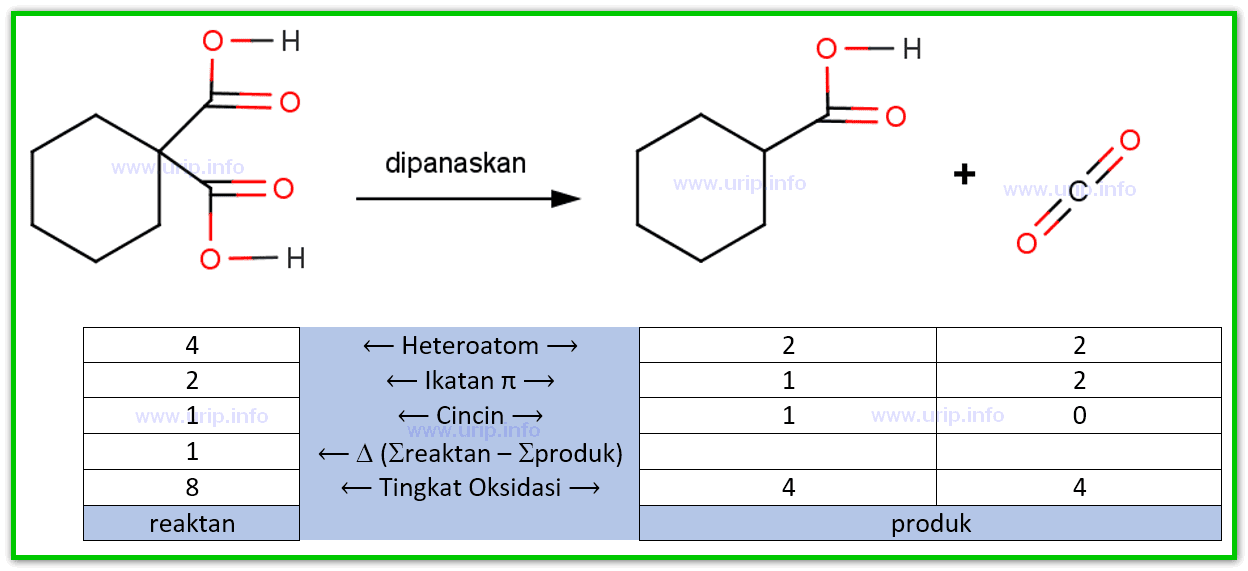
Teknik Penentuan Biloks Unsur pada Senyawa Organik Urip dot Info
Bilangan Oksidasi Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif.. (Li, Na, K, Rb, Cs, Fr), bilangan.

Aturan Biloks Kls X PDF
Dalam mata pelajaran Kimia juga ada bilangan yang disebut bilangan oksidasi atau dikenal juga dengan nama biloks.. Bilangan oksidasi Li, K, Rb, Ca, Fr dalam semua senyawanya adalah +1. 6. Bilangan oksidasi unsur-unsur golongan alkali tanah (IIA) dalam berbagai senyawa yang dibentuknya adalah +2.

Biloks & Penyetaraan Reaksi Redoks Metode Setengah Reaksi Reaksi Redoks Kimia Kelas 12 YouTube
elektron / Penurunan biloks Reaksi oksidasi : - Reaksi penangkapan oksigen / Reaksi pelepasan elektron / Kenaikan biloks. P 4 b. jumlah biloks atom dalam senyawa netral = 0 c. jumlah biloks atom dalam ion = muatan ion Prioritas biloks : IA : Li, Na, K, Rb, Cs, B = + IIA : Be, Mg, Ca, Sr, Ba, B = +2 Yang atas didahulukan. Al, B = +3.

Aturan penentuan biloks
Reaksi redoks berdasarkan bilangan oksidasi terjadi karena adanya pertambahan dan penurunan bilangan oksidasi. Pertambahan biloks disebut juga sebagai reaksi oksidasi, sedangkan penurunan biloks disebut juga sebagai reduksi. Untuk lebih mendalami reaksi redoks berdasarkan bilangan oksidasi perhatikan contoh soal reaksi redoks berikut ini. Soal No. 1 Tentukan bilangan oksidasi dari: Logam.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
konsep mudah menentukan bilangan oksidasi atau biloks . kimia sma

Biloks H Studyhelp
The crystal structure of sintered ceramics was analyzed by X-ray diffraction (XRD, Smartlab3kw, Rigaku). A quasi-static d 33 meter (Zj-2, Institute of acoustics, Chinese Academy of Sciences) was used to determine the piezoelectric constant d 33.In order to obtain the thermal-depoling performance, the polarized samples were annealed at different annealing temperature for 1 h and cooled them.
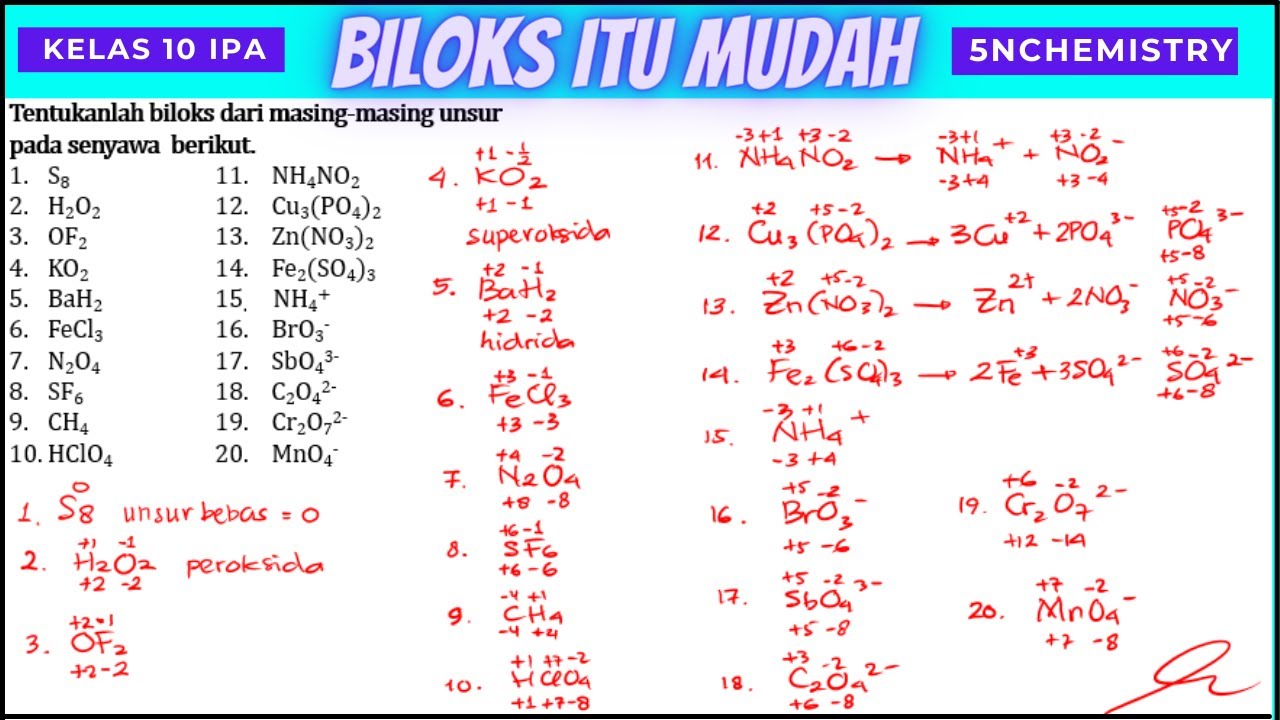
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Jumlah aljabar bilangan oksidasi seluruh atom-atom dalamsuatu senyawa netral adalah nol(0). Jumlah aljabar bilangan oksidasi seluruh atom-atom dalamsuatu ion adalah sama denganmuatan ion tersebut. Atom-atom golongan lA (Li, Na, K, Rb, Cs, dan Fr) dalamsenyawa selalu mempunyai bilangan oksidasi +1.