
Tentukan Bilang Oksidasi Setiap Atom Pada Senyawa Ion Di Bawah Ini Blog Ilmu Pengetahuan
Wati Sukmawati, M.Pd dalam bukunya Redoks dan Elektrokimia: Bintang Pusataka (2020: 36) memaparkan, bilangan oksidasi adalah jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menunjukkan elektron yang sudah diserahkan maupun diterima oleh atom lainnya. Perlu di garis bawahi, beberapa atom hanya mempunyai satu biloks..

Bilangan Oksidasi H Bernilai Negatif Terdapat Pada Senyawa Mobile Legends
Bilangan oksidasi juga dipelihara dalam artikel suatu unsur (tentu saja), dan secara sistematis dalam tabel {{Kotak info unsur/symbol-to-oxidation-state}} Pemeliharaan & peningkatan. Untuk pemeliharaan: kedua daftar dibandingkan dalam /datacheck ini, untuk mendapatkan perbaikan bersama. Pada April 2022, untuk 12 unsur yang dibandingkan.

BAGAIMANA CARA MENENTUKAN BILANGAN OKSIDASI (BILOKS)?
Menggunakan peraturan penetapan bilangan oksidasi, tetapkan bilangan-bilangan oksidasi atom-atom lain dalam senyawa. Hati-hati untuk kasus khusus seperti O, H, dll. Dalam Na 2 SO 4 , kita tahu bahwa, berdasarkan peraturan kita, ion Na memiliki muatan (dan dengan demikian bilangan oksidasinya) +1 dan atom oksigen memiliki bilangan oksidasi -2.
Cara Menentukan Bilangan Oksidasi Matob
Sedangkan, unsur H akan mengalami penurunan bilangan oksidasi dari +1 ke 0, jadi akan mengalami reaksi reduksi. Oleh sebab itu, HCl dinamakan sebagai oksidator. Pengertian Oksidator dan Reduktor. Oksidator merupakan senyawa yang mempunyai kemampuan dalam hal mengoksidasi senyawa lainnya atau biasa dikenal senyawa menerima elektron. Dimana.

Cara Cepat Menentukan Bilangan Oksidasi
Untuk menentukan bilangan oksidasi dengan benar, ada 9 aturan yang perlu Anda patuhi. Aturan-aturan tersebut yaitu: Unsur bebas memiliki biloks = 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas dibagi menjadi 2, yaitu unsur bebas berbentuk atom, misalnya C, Ca, Cu, Na, Fe, Al, Ne dan.

9 Aturan Bilangan Oksidasi Yang Perlu Anda Ketahui
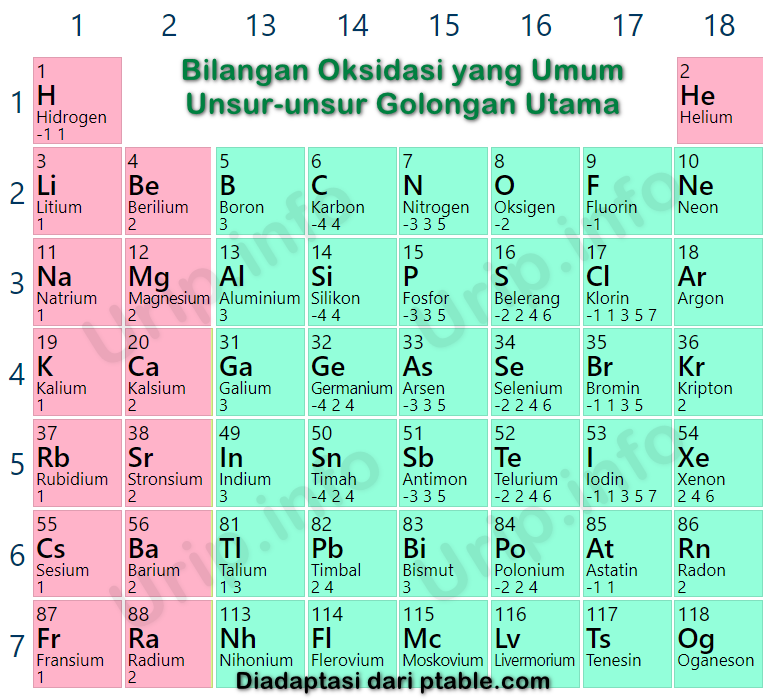
Pada ion OH-, bilangan oksidasi O ditambah dengan bilangan oksidasi H = -1. Pada ion SO42-, bilangan oksidasi S ditambah dengan 4 kali bilangan oksidasi O = -2. Pada ion NH+4, bilangan oksidasi N ditambah dengan 4 kali bilangan oksidasi H = +1. 5. Bilangan oksidasi unsur-unsur golongan alkali (IA) dalam berbagai senyawa yang dibentuknya adalah +1

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Bilangan oksidasi unsur H pada H 2 O, HCl, H 2 S, dan NH 3 ialah +1. Bilangan oksidasi unsur H pada NaH, CaH 2, dan AlH 3 ialah -1. 6. Bilangan oksidasi unsur O pada senyawanya ialah -2, kecuali :', yaitu: 1. Pada senyawa biner dengan F, bilangan oksidasinya ialah +2. 2. Pada senyawa peroksida, seperti H 2 O 2, Na 2 O 2 dan BaO 2 , bilangan.

Menghitung Bilangan Oksidasi Unsur
Hidrogen pada Senyawa Hidrida (Senyawa Hidrogen Logam) memiliki Bilangan Oksidasi -1. Contohnya Atom H mempunyai Biloks +1 di Senyawa HCI, HBr, HNO3 dan H2SO4. 4. Aturan Bilangan Oksidasi Yang Keempat adalah Atom Logam dlm Senyawa mempunyai Bilangan Oksidasi sesuai dg jumlah elektron valensi dari Atom Logam tersebut. Seperti contohnya jika.

Cara Menentukan Bilangan Oksidasi dan Contohnya
Contoh bilangan oksidasi H pada H 2 O, NH 3, dan HBr adalah +1. Bilangan oksidasi pada senyawa hidrida seperti LiH dan NaH adalah -1. Secara umum, unsur O memiliki bilangan oksidasi -2, kecuali pada senyawa peroksida memiliki bilangan oksidasi -1.

Cara Menentukan Bilangan Oksidasi Matob
7. Bilangan Oksidasi Hidrogen (H) adalah +1 Bila Berikatan dengan Non-Logam dan -1 Bila Berikatan dengan Logam. Contoh dari penerapan aturan ini seperti misalnya pada AlH 3 bilangan oksidasi H = -1. Pembuktian biloks H berdasarkan: Peraturan poin 3: Al memiliki bilangan oksidasi +3 karena termasuk unsur logam golongan IIIA

Cara Perubahan Bilangan Oksidasi Coretan
Bilangan oksidasi hidrogen yang berikatan dengan non logam sama dengan +1, misalnya HCl dan H2O. Bilangan oksidasi golongan IA dalam senyawa adalah +1, misalnya H, Li, dan Na. Bilangan oksidasi golongan IIA dalam senyawa adalah +2, misalnya Mg, Ca, dan Sr. Bilangan oksidasi golongan IIA dalam senyawa adalah +3, misalnya B, Al, dan Ga.
Catatan tentang Bilangan Oksidasi Serba Ada
Misalnya bilangan oksidasi unsur H pada NaH, CaH2, dan AIH3 adalah -1; 6. Bilangan oksidasi unsur O pada senyawanya adalah -2, kecuali pada senyawa biner dengan F, bilangan oksidasi unsur O-nya adalah +2. Bilangan oksidasi unsur O pada senyawa proksida, seperti H2O2 dan BaO2 adalah -1. Dalam senyawa superoksida, bilangan oksidasinya adalah -1/2.

Menghitung Bilangan Oksidasi Unsur
Bilangan oksidasi unsur O pada H 2 O, KOH, H 2 SO 4 dan Na 3 PO 4 adalah -2. 7. Jumlah bilangan oksidasi unsur-unsur dalam senyawa adalah 0 (nol). ' Jumlah bilangan oksidasi unsur-unsur pembentuk ion poliatom sama dengan muatan ion poliatomnya.

6+ Bilangan Oksidasi H Bernilai Negatif Terdapat Pada Senyawa Baru Kursus Digital
Penentuan nilai oksidasi didasarkan atas perbedaan harga keelegtronegatifannya , unsur yang lebih besar elektropositif nilai biloksnya negatif. NO. ATURAN. CONTOH. 1. Bilangan oksidasi unsur bebas adalah nol. Bilangan oksidasi atom-atom pada C,Ne,H 2 ,O 2 ,Cl 2 ,P 4 ,S 8 ,Cu,Fe,Na adalah nol. 2. Bilangan oksidasi senyawa atau molekul adalah nol.
Mengapa Cl Mempunyai Bermacammacam Bilangan Oksidasi? Urip dot Info
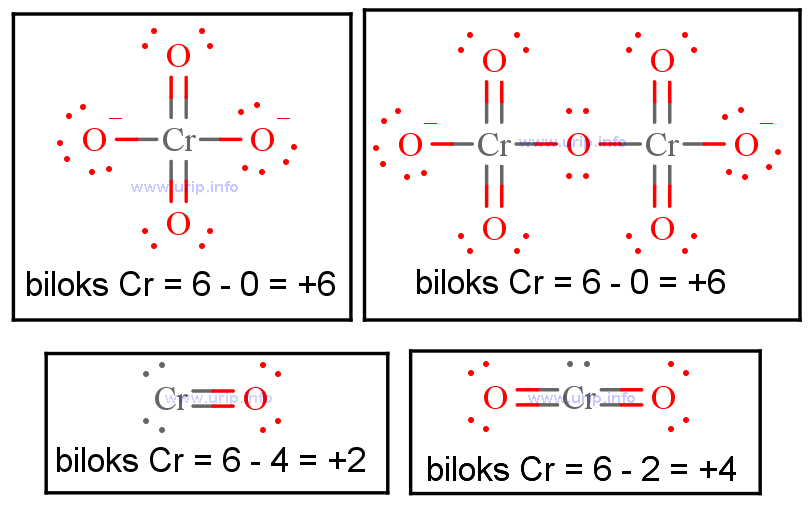
Pembahasan: H 2 SO 4 merupakan suatu senyawa, kita tahu aturannya bahwa nilai biloks dari suatu senyawa adalah nol. Kalau dirinci akan seperti ini: (2 x biloks H) + (1 x biloks S) + (4 x biloks O) = (2×1) + (1xbiloks S) + (4x (-2)) = 0. → 2 + biloks S - 8 = 0. → biloks S = +6. Itu dia penjelasan singkat mengenai bilangan oksidasi beserta.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Bilangan oksidasi unsur H pada senyawa hidrida adalah -1. Misalnya, bilangan oksidasi unsur H pada NaH, CaH₂, dan AlH3 adalah -1. 7. Jumlah bilangan oksidasi unsur-unsur yang membentuk ion = jumlah muatannya. Contoh: NH₄+ = +1 Biloks H = +1. Atom H memiliki indeks 4, maka biloks H dikalikan dengan indeks H = +4. Karena jumlah muatan NH₄.