
Contoh Bilangan Kuantum Ilmu Kimia
Blog Bimbingan Akademik Kimia 4 Jenis Bilangan Kuantum Beserta Studi Kasus. Cara kerja alam semesta memang tidak henti-hentinya membuat kita takjub. Tidak hanya alam semesta yang diciptakan dengan teratur dan rapi oleh Sang Pencipta seperti planet-planet yang mengelilingi matahari tanpa pernah bertabrakan sekalipun.

Contoh Bilangan Kuantum Panduan Lengkap dan Terperinci
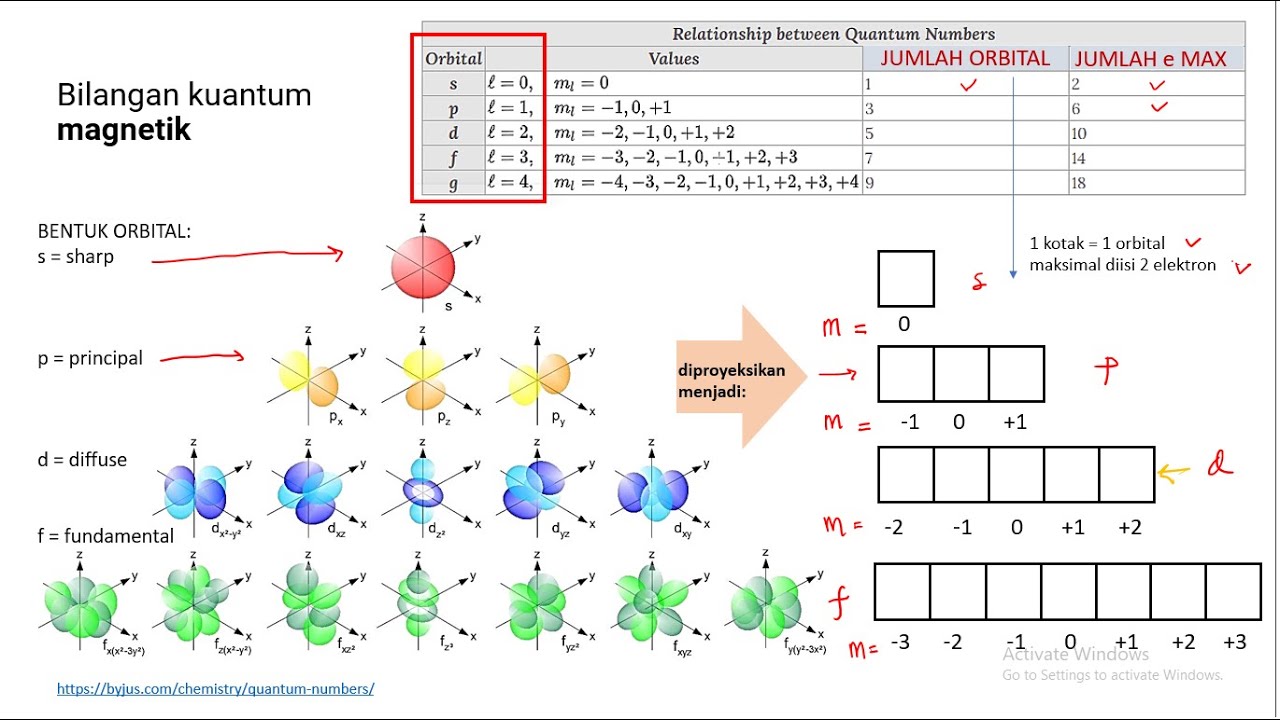
3. Bilangan kuantum magnetik (m) Menyatakan orientasi orbital dalam subkulit. Nilainya adalah dari -l sampai +l . Contoh: Untuk l=0, maka m= 0. Untuk l=1, maka m= -1, 0, +1. Untuk l=2, maka m= -2, -1, 0, +1, +2. 4. Bilangan kuantum spin (s) Menggambarkan arah rotasi atau putaran elektron dalam satu orbital. Dimana hanya ada 2 arah putaran yang.

Berikut ini adalah deretan bilangan kuantum yang dimiliki...
Bilangan kuantum diwakili sebuah nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital. Selain itu, bilangan kuantum menyatakan tingkat energi utama, jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron.
Belajarkimiapintarok Trik Menentukan Bilangan Kuantum
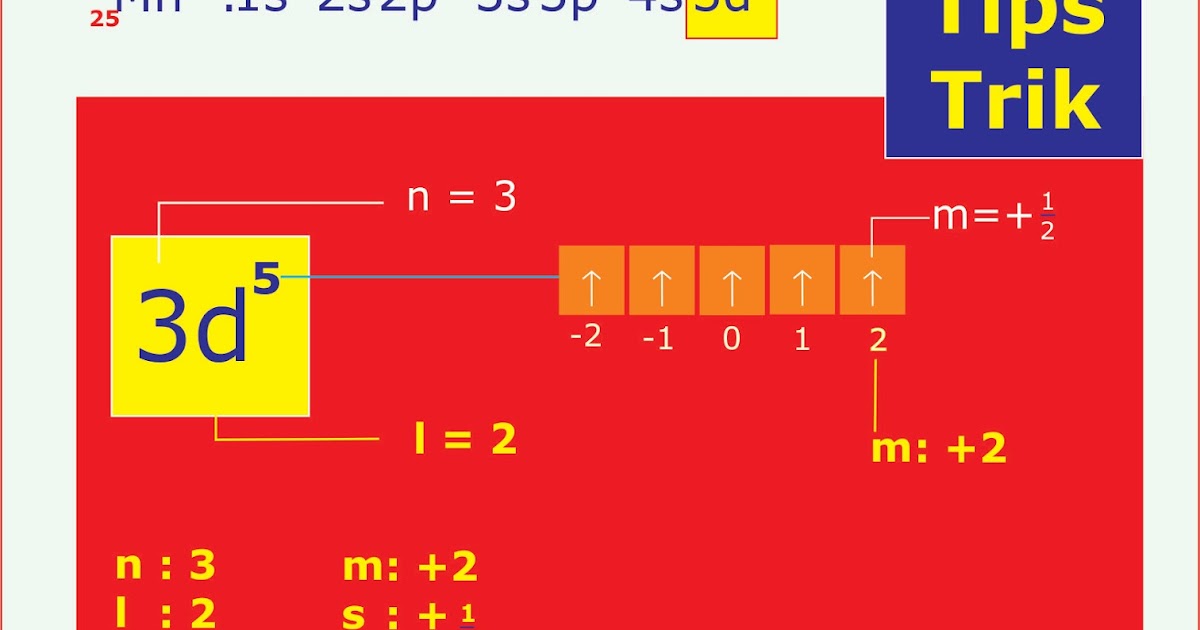
Bilangan kuantum merupakan sebuah bilangan yang memiliki arti atau parameter khusus untuk menjelaskan sebuah keadaan sistem kuantum.. Bentuk orbital mengacu pada letak atau subkulit yang mungkin ditempati oleh elektron.. Oleh karena itu pada konfigurasi atom Cr memiliki konfigurasi 24 Cr: [Ar] 4s 1 3d 5. Contoh Soal. Berikut merupakan.
PPT MODEL ATOM MEKANIKA KUANTUM PowerPoint Presentation, free download ID5731960
Bilangan kuantum utama menyatakan tingkat energi utama elektron suatu atom atau menunjukkan kulit atom. Kalau Sobat Zenius ingat model atom Bohr, bilangan dengan lambang "n" ini melambangkan kulit atomnya, nih. Nah, Sobat Zenius, gue punya rekomendasi video materi singkat yang ngebahas soal bilangan kuantum utama, nih.

TRIK MENENTUKAN BILANGAN KUANTUM KIMIA OKE PINTAR
Yuk, belajar cara mencari bilangan kuantum dengan mudah melalui artikel Kimia kelas X berikut ini! —. Sadar nggak sih, kalau dunia kita ini penuh sekali akan berbagai hal yang teratur dengan rapi. Mulai dari matahari yang terbit dari arah Timur hingga terbenam ke arah Barat. Kemudian, ada bumi yang mengelilingi matahari dalam dua belas bulan.

Subkulit Yang Tidak Mungkin Ada Dalam Suatu Atom Adalah Tugas sekolah
1. Bilangan kuantum utama. Disimbolkan dengan huruf (n) yang menyatakan tingkat energi. 2. Bilangan kuantum azimut atau momentum sudut. Disimbolkan (ℓ) yang menyatakan bentuk orbital. 3. Bilangan kuantum magnetik. Disimbolkan dengan huruf (m) yang menyatakan orientasi orbital dalam ruang tiga dimensi.

UTBK 2020 KIMIA no 1 Bilangan Kuantum yang mungkin adalah.. YouTube
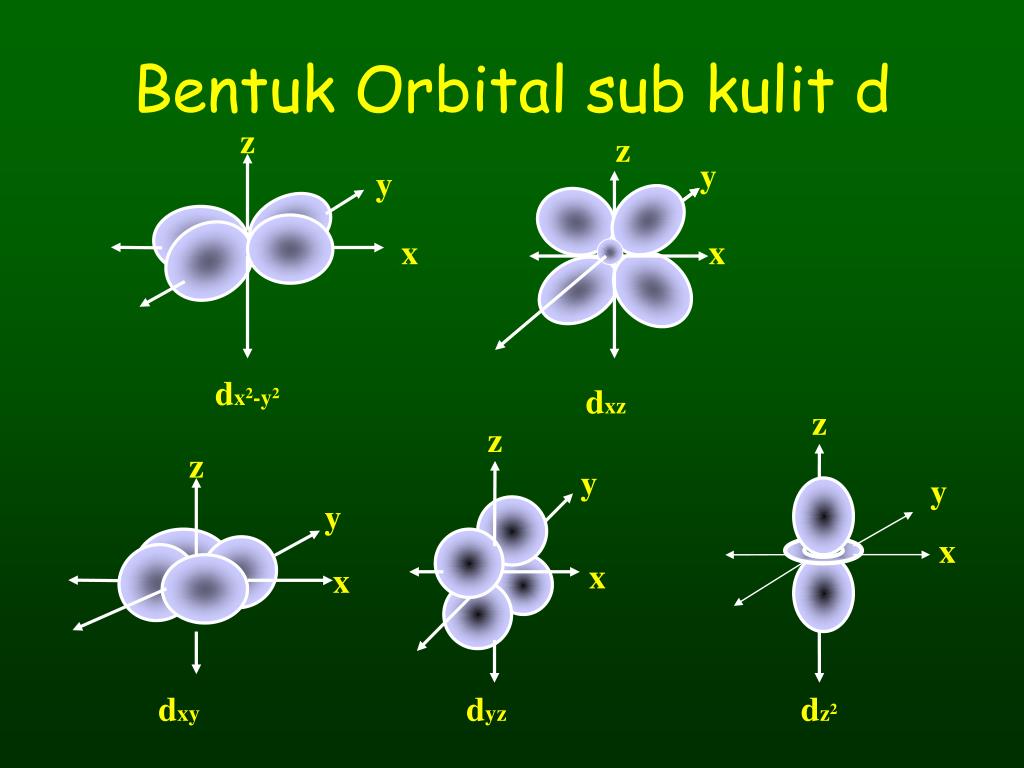
Bilangan kuantum magnetik ini, mendeskripsikan orientasi orbital. Nilai m l yang diperbolehkan merupakan bilangan bulat dari −l sampai +l. Subkulit-s ( l =0) punya harga m=0, artinya subkulit-s cuma punya 1 buah orbital. Maka, m=0, orbital-s gak punya orientasi dalam ruang jadi bentuk orbital-s dikukuhkan berupa bola yang simetris.

Kimia Kelas 10 Bilangan Kuantum Spin Bit CDN
KOMPAS.com - Bilangan kuantum adalah bilangan yang menggambarkan kedudukan suatu elektron dalam model atom mekanika kuatum yang dicetuskan oleh Erwin Schrodinger.. Dilansir dari Khan Academy, model atom mekanika kuantum berangkat dari hipotesis Louis de Broglie dan prinsip ketidakpastian Heisenbersg.. Model atom mekanika kuantum adalah model atom yang paling diyakini karena bisa menjelaskan.

deret bilangan kuantum berikut yang menyatakan kedudukan suatu elektron pada subkulit 3p adalah
Bilangan kuantum azimuth atau juga dapat dikatakan sebagai kuantum momentum sudut merupakan bilangan kuantum yang menggambarkan bentuk orbital yang ditempati elektron. Nilai bilangan kuantum azimuth sama dengan jumlah total sudut dalam orbital. Bilangan ini digambarkan dalam nilai berkisar antara 0 hingga n-1 dimana n adalah bilangan kuantum utama.
3 Bilangan Kuantum dan Konfigurasi Elektron Atom dan Sistem Periodik Unsur Kimia SMA X
Selain itu ada juga bilangan kuantum spin (ms) yang memberikan informasi spin suatu elektron dalam sebuah orbital. Setiap elektron memiliki satu set empat bilangan kuantum yang unik yaitu n, l, ml, dan ms. Dibawah ini penjelasannya: 1. Bilangan Kuantum Utama (n) Bilangan Kuantum Utama (n) menyatakan nomor kulit tempat elektron berada.

Cara Membuat Keempat Bilangan Kuantum Dari Suatu Unsur Panduan Kimia + Riset
Berikut merupakan bilangan kuantum yang mungkin dari subkulit 3d, kecuali HOTS 11. Orbital 3d b elektron ba orbital ini p ini disebab a. nilainc a n = 3 c. l = 2 e. s = - 1/2 4p seh renda b. nilai n orbita yang c. tingk diba d. nilai e. nilai b. m = 0 d. m = 3

Soal Dan Pembahasan Bilangan Kuantum
Karena elektron berada pada subkulit 3d, maka n = 3, l = 2. Nilai m yang mungkin = -2, -1, 0, 1, 2. 2. Jika sebuah elektron menempati orbital dengan nilai dari bilangan kuantum magnetik (m) = -1, maka tentukan tiga kemungkinan nilai dari bilangan kuantum utama (n), kuantum azimuth (l), dan bilangan kuantum spin (s).

Nilai keempat bilangan kuantum berikut yang mungkin untuk...
Bilangan kuantum spin (s) menunjukkan arah putaran elektron dlam orbital. Pada orbital maksimum 2 elektron dengan arah berlawanan. S berharga (searah jarum jam) dan (berlawanan jarum jam) Dari pilihan jawaban, bilangan kuantum yang tidak mungkin adalah E, karena bilangan kuantum magnetiknya terletak pada subkulit p, ditandai dengan nilai.

Bilangan Kuantum yang Mungkin YouTube
Bilangan kuantum menggambarkan sifat elektron dalam orbital. [1] Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum. [2] Bilangan kuantum merupakan salah satu ciri khas dari model atom mekanika kuantum.

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya SainsPedia
Nomor kuantum utama adalah bilangan bulat yang merupakan jumlah kulit elektron. Nilainya 1 atau lebih tinggi (tidak pernah 0 atau negatif). Bilangan kuantum momentum sudut adalah bilangan bulat yang merupakan nilai dari orbital elektron (misalnya, s = 0, p = 1). ℓ lebih besar dari atau sama dengan nol dan kurang dari atau sama dengan n-1.