
LKPD Bilangan Kuantum Dan Bentuk Orbital PDF
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Bentuk orbital ditentuka.

Bilangan Kuantum dan Bentuk Orbital Laman 3 dari 3 MateriKimia
Bilangan bulat ini dinamakan bilangan kuantum (perhatikan Gambar 1.1). Selama elektron berada pada tingkat energi tertentu, misalnya n=1, energi elektron tetap. Artinya, tidak ada energi yang diemisikan (dipancarkan) maupun diserap. Elektron dapat beralih dari satu tingkat energi ke tingkat energi lain disertai perubahan energi.

Bentuk orbital elektron dengan bilangan kuantum l=1 dan m...
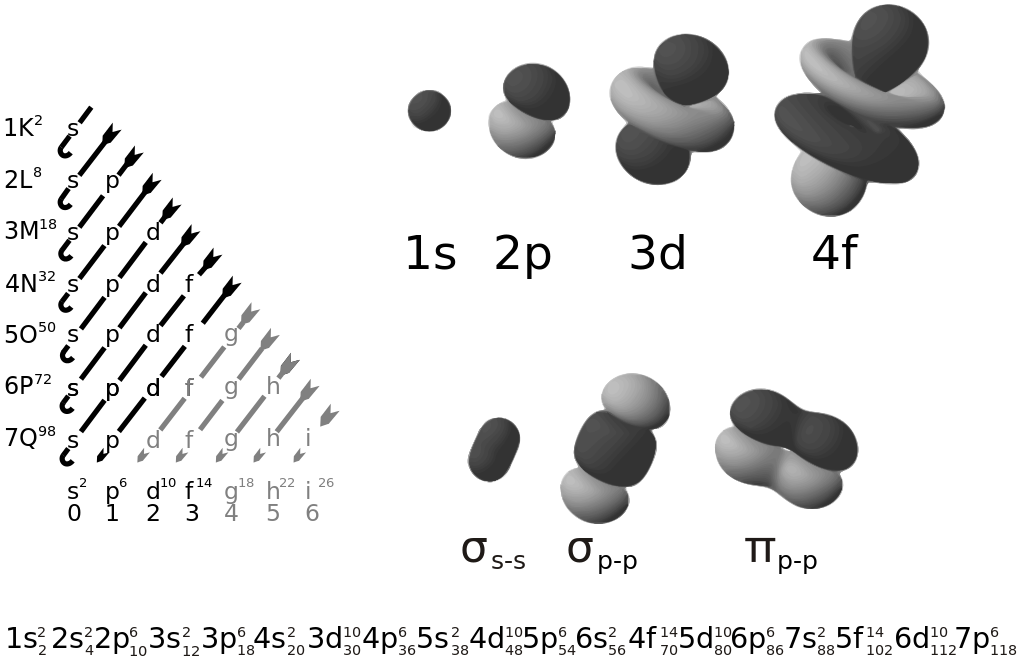
Bilangan kuantum utama, azimut, dan magnetik diperoleh dari fungsi gelombang, sedangkan bilangan kuantum spin diperoleh dari perilaku elektron yang berputar pada sumbunya (rotasi). Bilangan Kuantum Utama Bilangan kuantum utama disimbolkan dengan huruf $n$. Bilangan ini menunjukkan ukuran orbital dan tingkat energi elektron, yang disebut kulit atom.

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya SainsPedia
Juli 29, 2022 0 Gimana sih konsep bilangan kuantum utama, azimut, magnetik, dan spin yang dipelajari pada materi Kimia kelas 10? Yuk, kita bahas bersama-sama pada artikel kali ini. Pada mata pelajaran Kimia kelas 10, tentunya kita mulai mempelajari ilmu kimia dengan lebih dalam, dibanding ketika kita masih duduk di bangku SMP.

Contoh Bilangan Kuantum Panduan Lengkap dan Terperinci
1. Bilangan kuantum utama (n) Menggambarkan lintasan elektron atau tingkat energi utama. Semakin besar nilai n, semakin besar pula nilai rata-rata energi kulit tersebut karena letaknya yang semakin jauh dari inti atom. Padanannya dengan lambang kulit K, L, M dst adalah 2. Bilangan kuantum azimut (l) (n-1)

Soal Dan Pembahasan Bilangan Kuantum
Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik, yaitu bilangan kuantum utama (n), azimuth (atau momentum angular) (l), dan magnetik (ml). Ketiga bilangan tersebut mendeskripsikan tingkat energi orbital, ukuran, bentuk dan orientasi dari distribusi probabilitas radial orbital atom.

Bentuk Ukuran Dan Tingkat Energi Orbital Ditentukan Oleh Bilangan Kuantum pohon dadap daun
Bilangan kuantum (Inggris: Quantum number) adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.. Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron.

Bentuk Orbital Ditentukan Oleh Bilangan Kuantum Berbagi Bentuk Penting
Contoh Soal Bilangan Kuantum dan Bentuk Orbital Essay Soal No. 1 Tentukan bilangan kuantum unsur - unsur berikut! a. 16S b. 28Ni c. 35Br Pembahasan: a. 16S = 1s2 2s22p6 3s2. dan magnetik yang mungkin dimiliki oleh elektron yang menempati subtingkat energi 3d! Pembahasan: Subkulit 3d, berarti harga n = 3 dan l = 2. Jika l = 2 maka m = -2, -1.

Kelas X Struktur Atom 4 Bilangan Kuantum dan Bentuk Orbital YouTube
Bilangan kuantum adalah serangkaian bilangan bulat atau pecahan sederhana yang digunakan untuk menjelaskan, dengan cara yang sederhana, cara elektron-elektron ini disusun di sekitar nukleus . Bilangan kuantum ini memungkinkan kita untuk menentukan daerah di ruang angkasa tempat elektron dapat ditemukan, yang disebut orbital atom.

Bentuk Orbital Ditentukan Oleh Bilangan Kuantum Berbagi Bentuk Penting
Bilangan Kuantum: Bentuk, Orbital Atom, dan Contohnya [LENGKAP] Sumber Dribbble.com Daftar Isi+ Bilangan kuantum merupakan sebuah bilangan yang memiliki arti atau parameter khusus untuk menjelaskan sebuah keadaan sistem kuantum. Pada awalnya kita mungkin telah mempelajari beberapa teori tentang atom yang sederhana seperti teori John Dalton.
Bagaimana Bentuk Orbital Ditentukan Oleh Bilangan Kuantum Azimut?
Bilangan kuantum spin (s) berfungsi untuk menunjukkan arah putaran elektron pada sumbunya (rotasi) dengan arah berlawanan jarum jam atau searah jarum jam. Satu orbital hanya bisa ditempati oleh maksimum dua elektron, sedangkan elektron tersebut harus memiliki spin yang berlawanan.

Belajar Kimia Online Bilangan Kuantum dan Bentuk Orbital YouTube
Jawaban terverifikasi Pembahasan Bilangan kuantum dibedakan menjadi bilangan kuantum utama, bilangan kuantum azimuth, bilangan kuantum magnetik, dan bilangan kuantum spin. Bilangan kuantum azimuth menentukan bentuk orbital dan subtingkatan energi. Dalam tiap orbital, elektron menyebar di sekitar inti.

Bilangan Kuantum Pengertian, Contoh Soal, Bentuk Orbital
Orbital atom umumnya dideskripsikan sebagai fungsi gelombang "bak hidrogen" dengan bilangan kuantum n, l, m yang berkorespondensi dengan energi, momentum sudut, dan arah momentum sudut pasangan elektron secara berurutan.
Bentuk Orbital Ditentukan Oleh Bilangan Kuantum Berbagi Bentuk Penting
Dalam mekanika kuantum, persamaan Schrödinger adalah persamaan matematika yang menjelaskan perubahan tiap waktu dari sebuah sistem fisika di mana efek kuantum, seperti dualitas gelombang-partikel, menjadi signifikan. Persamaan ini merupakan perumusan matematis untuk mempelajari sistem mekanika kuantum. Persamaan ini diajukan oleh fisikawan Erwin Schrödinger pada tahun 1925 dan.

Cara Menentukan Bilangan Kuantum Elektron Aturan Prinsip Konfigurasi Riset
Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik, antara lain bilangan kuantum utama (n), azimuth (atau momentum angular) (l), dan magnetik (m l ). Ketiga bilangan kuantum tersebut dapat mendeskripsikan tingkat energi orbital dan juga ukuran, bentuk, dan orientasi dari distribusi probabilitas radial orbital atom.
STRUKTUR ATOM Bilangan Kuantum dan Bentuk Orbital Dimas B. Setyoko
1. Bilangan kuantum utama. Disimbolkan dengan huruf (n) yang menyatakan tingkat energi. 2. Bilangan kuantum azimut atau momentum sudut. Disimbolkan (ℓ) yang menyatakan bentuk orbital. 3. Bilangan kuantum magnetik. Disimbolkan dengan huruf (m) yang menyatakan orientasi orbital dalam ruang tiga dimensi.