
Menghitung pH Bagian 3 (Asam/Basa Kuat dan Lemah) Materi Larutan Asam Basa Kimia SMA Pojan
Titrasi ini mencari konsentrasi analit berupa asam kuat dengan larutan basa lemah sebagai standar. Titik ekuivalen titrasi asam kuat dengan basa lemah tidak tepat terjadi pada pH 7, namun pada pH yang lebih asam (pH = 5 - 6). Dilansir dari Khan Academy, hal tersebut diakrenakan basa lemah menghasilkan asam konjugasi selama titrasi.

Tips Cara Mudah Menghafal & Membedakan Asam Kuat, Asam Lemah, Basa Kuat, Basa Lemah YouTube
1 Pendahuluan 1.1 Basa Kuat 1.2 Basa Lemah 1.3 Perbedaan Kelebihan dan Kekurangan Basa Kuat 1.4 Perbedaan Kelebihan dan Kekurangan Basa Lemah 2 Tabel Perbandingan Basa Kuat dan Basa Lemah 3 Frequently Asked Questions (FAQ) 3.1 1. Apa itu basa kuat? 3.2 2. Apa itu basa lemah? 3.3 3. Apa contoh basa kuat? 3.4 4. Apa contoh basa lemah? 3.5 5.
Daftar Nama AsamBasa Kuat dan AsamBasa Lemah
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron. Sedangkan, basa adalah senyawa yang cenderung menyumbangkan sepasang elektron untuk dipakai bersama-sama dan menerima proton.

pH larutan basa kuat dan basa lemah Pembahasan UN KIMIA SMA tahun 2018 YouTube
-Basa kuat Pengertian basa kuat adalah senyawa basa yang akan terurai sempurna jika terlarut dalam air. Misalnya pada senyawa: NaOH, KOH, Ba(OH)2.-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada dala air. Misalnya pada senyawa basa NaHCO3, NH4OH. - Manfaat senyawa basa dalam.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
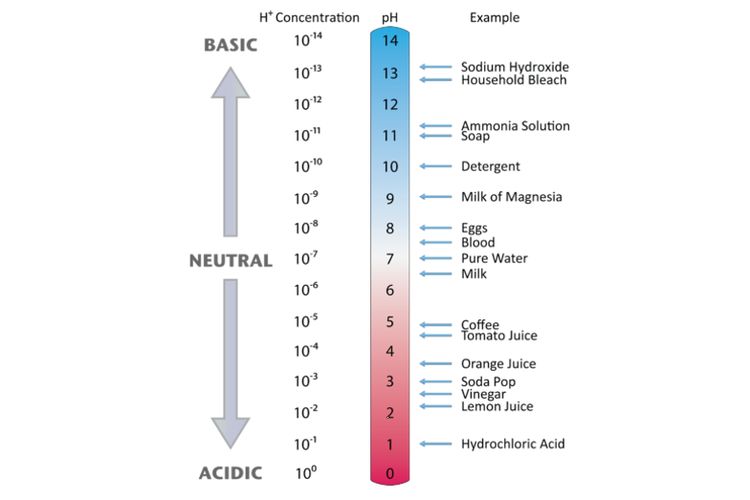
Ilustrasi Asam-Basa Kuat dan Asam-Basa Lemah ( Freepik.com) Sonora.ID - Dalam pelajaran Kimia, kita mengenal larutan asam, basa, dan garam, sesuai dengan pH yang ditunjukkan oleh larutan tersebut. Asam sendiri adalah zat yang menghasilkan ion Hidrogen (H+) dalam larutan, sedangkan basa menghasilkan ion Hidroksida (OH-) dalam larutan.

daftar nama asam basa kuat dan lemah.docx
Basa lemah akan memiliki konsentrasi H + yang lebih tinggi karena mereka kurang terprotonasi daripada basa kuat dan, oleh karena itu, lebih banyak ion hidrogen tertinggal dalam larutan. Jika Anda memasukkan konsentrasi H + yang lebih tinggi ke dalam rumus, hasil pH rendah.
Daftar Asam Basa Kuat Dan Lemah
1. Sifat Asam Rasa Asam yang Khas Bisa Mengubah Warna Indikator Bereaksi dengan Logam Tertentu Guna Menghasilkan Gas H2 Bereaksi dengan Basa Guna Membentuk Garam dan Air Bisa Menghantarkan Arus Listrik Oksida Asam 2. Sifat Basa Memiliki Rasa Pahit Basa Terasa Licin Bersifat Korosif Menghantarkan Arus Listrik Menetralkan Sifat Asam

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Seorang ahli kimia asal Swedia, Svante August Arrhenius (1859-1927) menjelaskan asam adalah suatu zat yang ketika dilarutkan dalam air akan terurai dan menghasilkan ion H+. Contoh zat asam misalnya hidrogen klorida (HCl), saat dilarutkan dalam air akan terurai menjadi ion H+ dan ion Cl-. Ciri-ciri asam yaitu:

pH basa kuat dan basa lemah YouTube
Turunan Alkana Sel Elektrolisis Garam dari asam kuat dan basa kuat Garam seperti NaCl yang dapat terbentuk dari reaksi basa kuat (NaOH) dan asam kuat (HCl) tidak dapat terhidrolisis sehingga larutannya bersifat netral. Anion Cl − merupakan basa konjugasi yang sangat lemah karena berasal dari asam kuat sehingga cenderung tidak dapat menarik proton.

TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
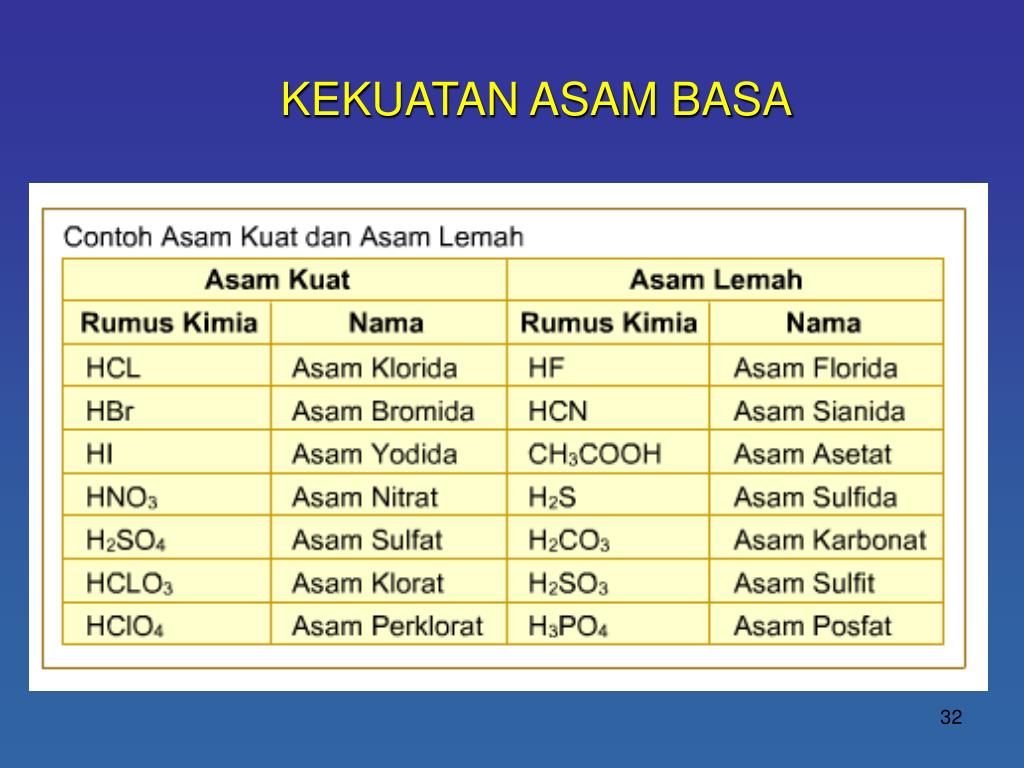
Asam klorida (HCl) Asam nitrat (HNO3) Asam sulfat (H2SO4) Asam klorat (HClO3) Asam perklorat (HClO4) Asam bromida (HBr) Asam hidrogen iodida (HI) Baca juga: Hujan Asam: Penyebab, Proses, Dampak, dan Cara Mencegahnya Asam lemah Asam lemah adalah larutan dengan pH di bawah tujuh dan di atas tiga.

pH Basa Kuat dan Basa Lemah YouTube
Sedangkan basa kuat adalah basa yang terdisosiasi sempurna dalam larutan. Dan basa lemah adalah basa yang hanya terdisosiasi sebagian dalam larutan. Pada tahun 1884, ahli kimia Swedia Svante Arrhenius mengusulkan dua klasifikasi senyawa tertentu, asam dan basa. Ketika dilarutkan dalam larutan berair, ion tertentu dilepaskan ke dalam larutan.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Kuat Superasam Lemah Padat Tipe Basa Brønsted-Lowry Lewis Donor Organik Oksida Kuat
Asam Basa ( Kuat & Lemah )
Pengertian basa kuat ialah jenis senyawa yang melepaskan proton (deprotonasi) pada asam sangat lemah secara sederhana dalam reaksi asam basa. Adapun contoh basa kuat yang paling umum ialah Hidroksida pada logan alkali, misalnya Ca (OH)2 maupun NaOH. Selain itu adapula beberapa contoh lain yang termasuk larutan basa kuat yaitu meliputi:
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
2. Reaksi antara asam kuat dan basa lemah. Reaksi asam dan basa juga bisa terjadi pada larutan dengan asam kuat dan larutan dengan basa lemah. Contoh: HBr (aq) + NH 3(aq) → NH 4 Br (aq) Dari contoh di atas, dapat diketahui bahwa HBr adalah asam kuat, sedangkan NH3 adalah basa lemah. Hasil reaksi antara asam kuat dan basa lemah ini dapat.

Daftar Asam Basa Kuat dan Lemah
Basa kuat adalah basa yang juga dapat terionisasi sempurna di dalam air (a=1). Contoh dari basa kuat seperti natrium hidroksida (NaOH), litium hidroksida (LiOH), kalium hidroksida (KOH), barium hidroksida (Ba(OH)2), dan kalsium hidroksida (Ca(OH)2). 2. Asam lemah dan basa lemah. Asam lemah adalah asam yang hanya terionisasi sebagian di dalam.

MENGHITUNG pH BASA KUAT DAN BASA LEMAH YouTube
Titrasi asam lemah dengan basa kuat. Sebagai contoh, 40 mL larutan CH 3 COOH 0,1 M ditetesi dengan larutan NaOH 0,1 M sedikit demi sedikit. Berikut kurva titrasi berwarna biru yang menggambarkan perubahan pH selama titrasi tersebut dibandingkan dengan kurva titrasi HCl dengan NaOH yang berwarna merah.