Jelaskan tentang konfigurasi elektron beserta cont...
Aturan Penulisan Konfigurasi Elektron. Berdasarkan teori atom Niels Bohr, elektron pada atom akan menempati kulit-kulit atom. Kulit K adalah kulit yang paling dekat dengan inti atom biasa ditempati oleh 2 elektron. Sementara pada kulit kedua yakni kulit L akan ditempati oleh 8 elektron, terus berikutnya hingga kulit paling luar dari atom.

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas. Atom helium. Helium atom ground state. Ilustrasi atom helium yang memperlihatkan inti atom (merah muda) dan distribusi awan elektron (hitam). Inti atom (kanan atas) berbentuk simetris bulat, walaupun untuk inti atom yang lebih rumit ia tidaklah selalu demikian. Klasifikasi.
KONFIGURASI ELEKTRON BERDASARKAN TEORI ATOM MEKANIKA KUANTUM YouTube
Konfigurasi Elektron. Selamat Datang dan Selamat Belajar di Wardaya College! Di sini, kamu akan belajar tentang Konfigurasi Elektron melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar). Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
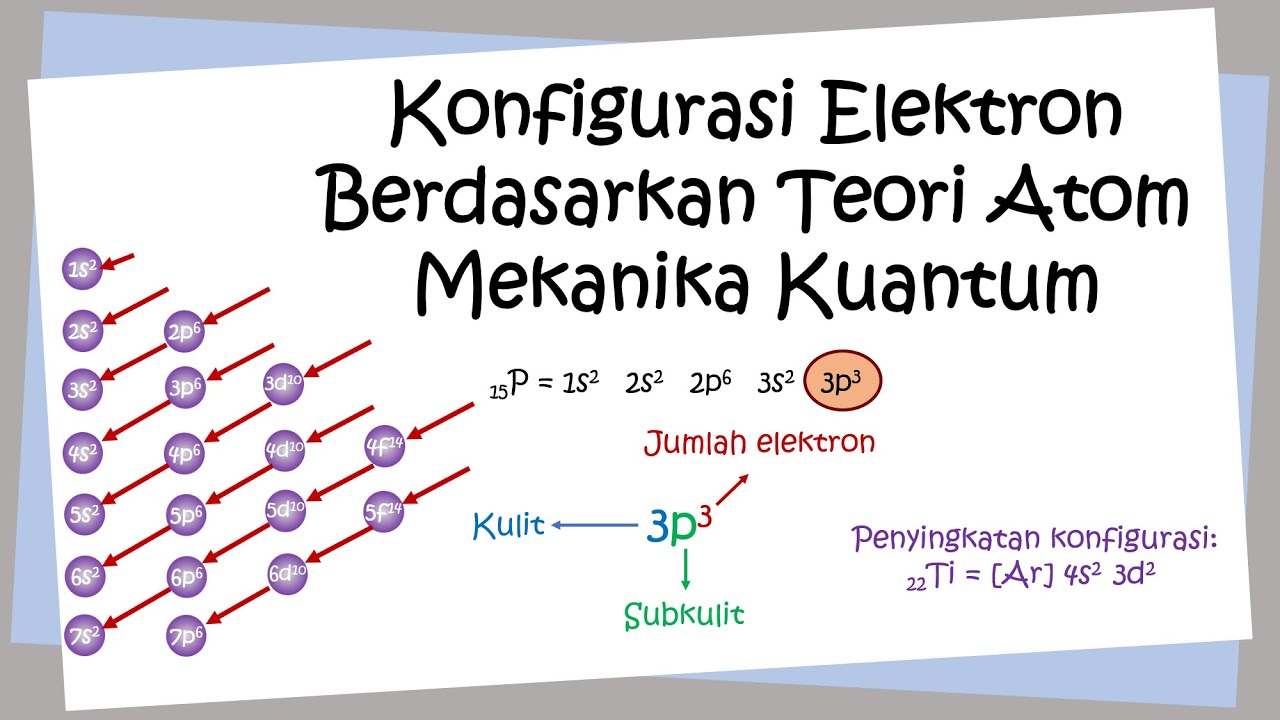
KOMPAS.com - Model atom mekanika kuantum menyatakan bahwa elektron berada pada orbital-orbital atom.. Atom-atom tersebut menempati orbital sesuai dengan susunannya, atau yang disebut sebagai konfigurasi elektron.. Aturan dalam konfigurasi elektron terdiri dari tiga yakni Prinsip Aufbau, Aturan Hund, dan Larangan Pauli.. Prinsip Aufbau. Dilansir dari Encyclopaedia Britannica, Prinsip Aufbau.
Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
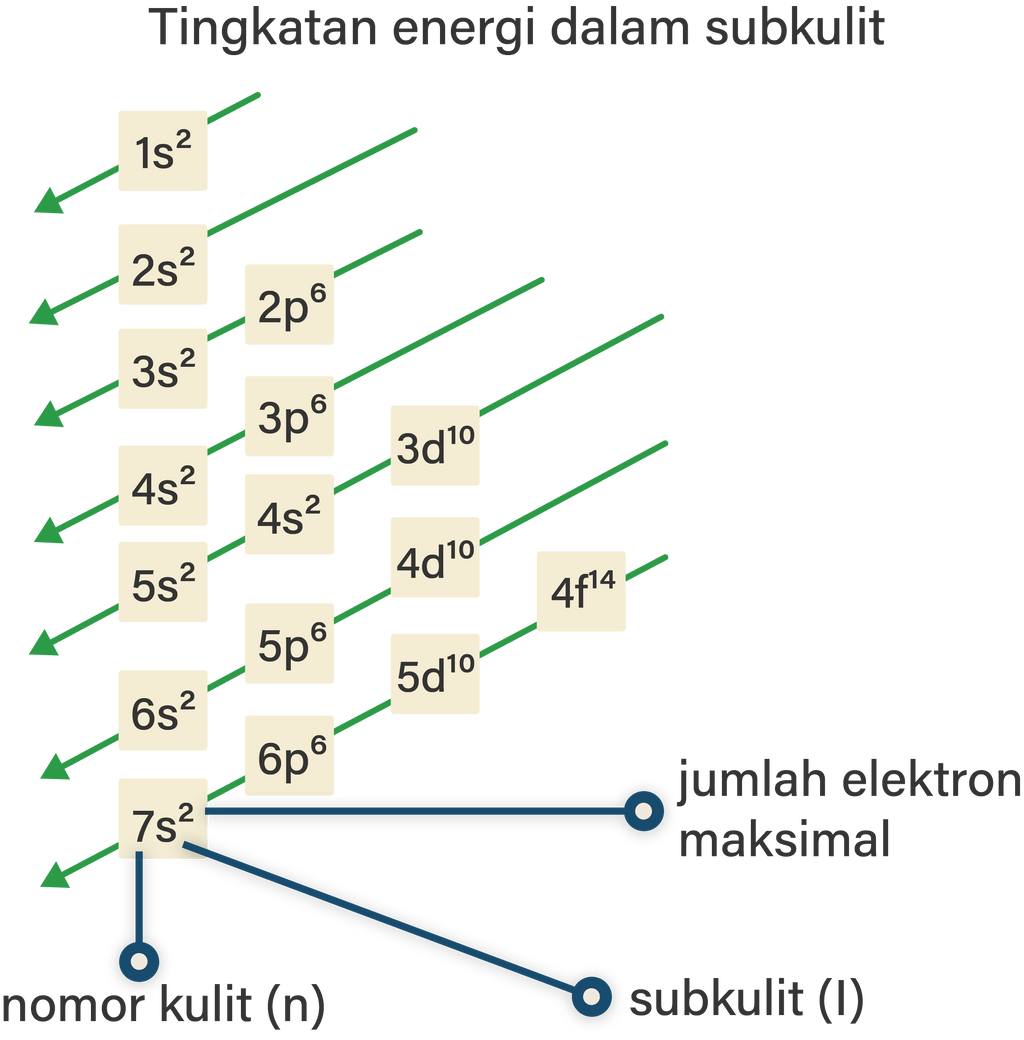
Aturan-Aturan Dasar Penentuan Konfigurasi Elektron. 1. Prinsip Aufbau. Prinsip ini ditemukan oleh seorang fisikawan dari Denmark bernama Niels Bohr. Prinsip Aufbau ini menjelaskan jika setiap elektron nantinya menempati orbital dengan bertahap dari subkulit yang terendah tingkat energinya menuju ke yang lebih tinggi.

Bilangan Kuantum, Aturan Konfigurasi Elektron, dan Bentuk Orbital YouTube
Nah sekarang kita akan menggambarkan konfigurasi elektron memakai diagram orbital, teman. Sebenarnya gambarnya cukup mudah kok. Suatu subkulit punya sejumlah orbital. Orbital itu digambarkan sebagai persegi dan berisi garis setengah panah yang mewakili elektron. Subkulit s punya 1 orbital, p punya 3 orbital, d punya 5 orbital, dan f 14 orbital.
Pengertian dan Pedoman Penulisan Konfigurasi Elektron SERBA SERBI
Aturan Penulisan Konfigurasi Elektron. Penulisan konfigurasi elektron mengacu pada beberapa aturan berikut. Prinsip Aufbau. Menurut prinsip ini, pengisian elektron harus dimulai dari subkulit dengan tingkat energi paling rendah. Setiap subkulit memiliki batas maksimal elektron yang harus diisikan, yaitu seperti pada pembahasan sebelumnya.

Konfigurasi Elektron
Terdapat aturan dalam konfigurasi elektron yakni : 1. Aturan Aufbau. Aturan Aufbau merupakan salah satu aturan yang paling digunakan dalam suatu konfigurasi elektron. Aturan ini menjelaskan tentang suatu pengisian orbital (fungsi matematika yang menggambarkan perilaku elektron) yang dimulai dari tingkat energi rendah ke yang tingkat energi tinggi.

CARA MENENTUKAN PERIODE DAN GOLONGAN BERDASARKAN KONFIGURASI ELEKTRON ATURAN AUFBAW
B. Aturan dalam Konfigurasi Elektron. Berdasarkan model atom mekanika kuantum, terdapat tiga aturan yang berlaku pada konfigurasi elektron yaitu: Asas larangan Pauli (Wolfgang Linus Pauli (1926)) Aturan Aufbau (Niels Bohr (1920)) Kaidah Hund (Friedrich Hund (1927)) 1. Asas Larangan Pauli.

Gambarkan Konfigurasi Elektron Untuk Atom Netral
Aturan-aturan penentuan konfigurasi elektron berdasarkan orbitalnya, terdiri dari asas aufbau, larangan pauli, kaidah Hund . Berikut adalah penjelasan setiap aturan asasnya: Asas Aufbau. Pengisian elektron dimulai dari subkulit dengan tingkat energi paling rendah ke lebih tinggi. Setiap subkulit mempunyai batasan elektron yang dapat diisikan yakni:
aturan konfigurasi elektron Ilmu Kimia
Tabel konfigurasi elektron. Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah hund, larangan pauli, serta hukum mekanika kuantum.

Konfigurasi Elektron Memahami Aturan Aufbauf, Aturan Hund dan Larangan Pauli YouTube
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.

Cara Menentukan Bilangan Kuantum Elektron Aturan Prinsip Konfigurasi Riset
Aturan Penulisan Konfigurasi Elektron E-book Cerdas Belajar Kimia juga menyebutkan, dalam penulisan konfigurasi elektron terdapat aturan yang disebut sebagai aturan Aufbau. Menurut aturan ini, elektron secara bertahap menempati orbital dimulai dari yang paling rendah. Setelahnya, elektron menempati orbital yang satu tingkat lebih tinggi, dan.

Pengertian Konfigurasi Elektron Ilmu Kimia
Di video ini, kamu akan belajar mengenai cara menyingkat konfigurasi elektron dengan gas mulia. Ada SUPERnya lho.! Selain itu, kamu juga akan belajar menge.
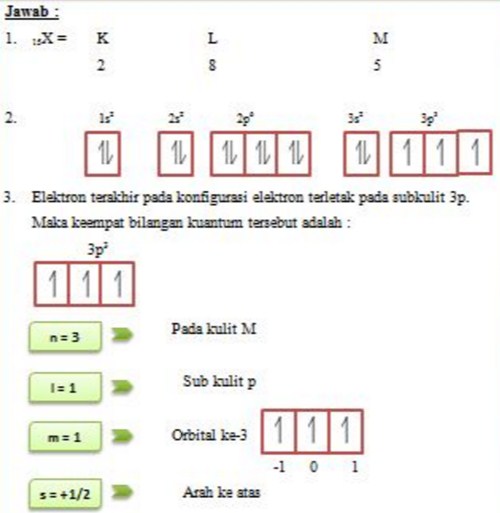
Konfigurasi Elektron Menurut Larangan Pauli Rumus Kimia
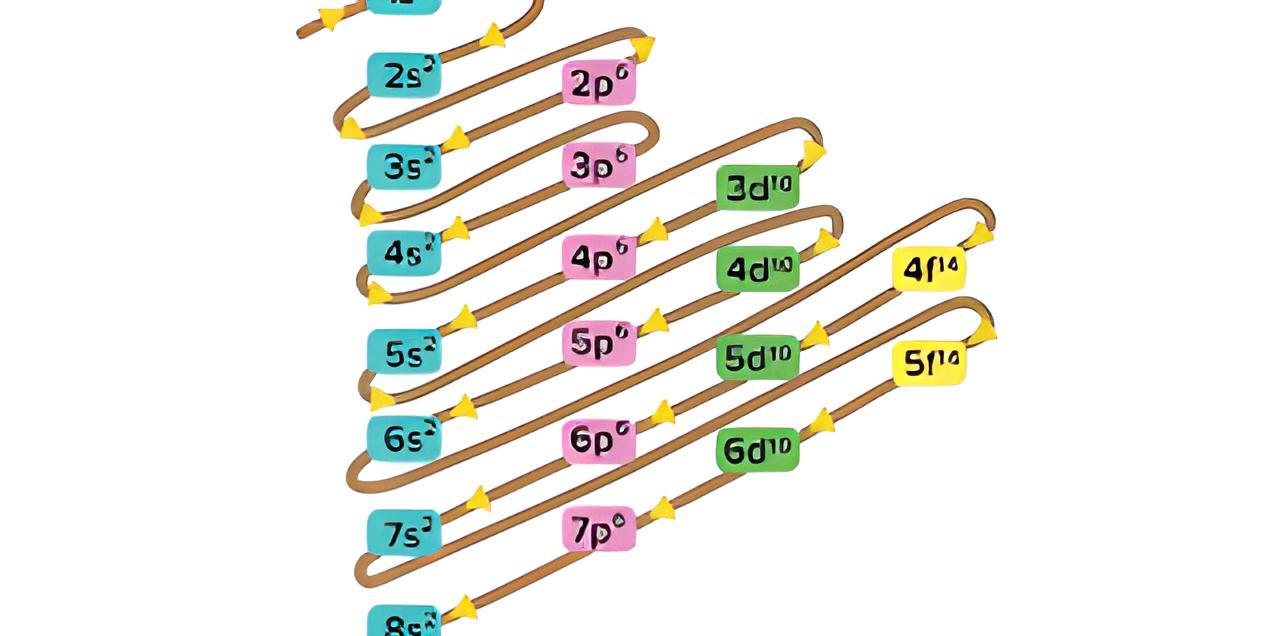
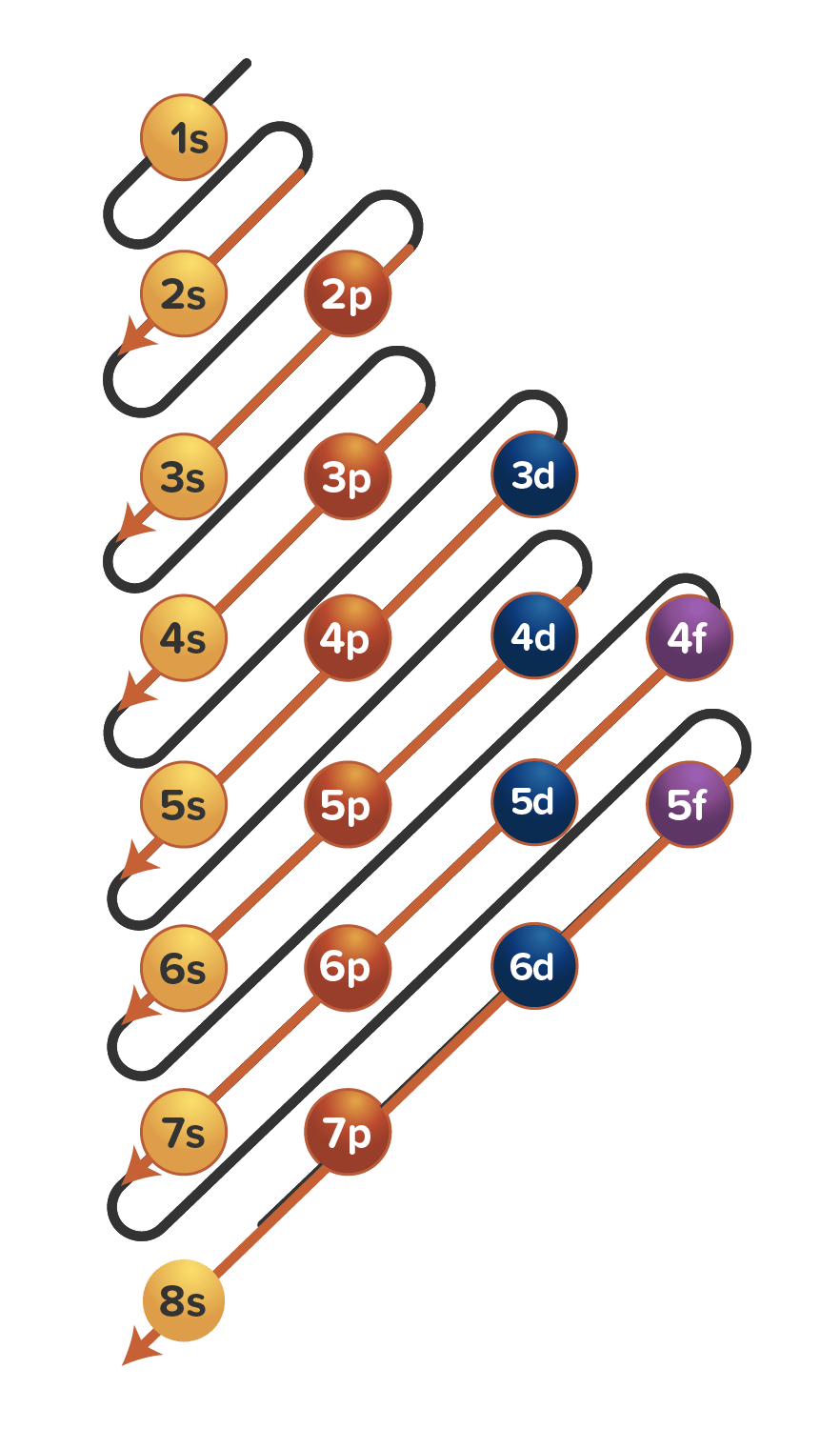
Aturan penentuan konfigurasi elektron berdasarkan orbital: 1. Asas Aufbau: Elektron menempati orbital-orbital dimulai dari tingkat energi yang terendah, dimulai dari 1s, 2s, 2p, dan seterusnya seperti urutan subkulit yang terlihat pada Gambar 2. Gambar 2. Urutan tingkat energi subkulit.
Tentukan konfigurasi elektron dari 26 Fe
Aturan Penulisan Konfigurasi Elektron. Ada beberapa aturan yang digunakan untuk menuliskan konfigurasi elektron , yaitu : 1. Asas Aufbau. Berdasarkan asas Aufbau, pengisian elektron pada orbital dimulai dari subkulit yang memiliki tingkat energi lebih rendah ke tingkat energi yang lebih tinggi.