
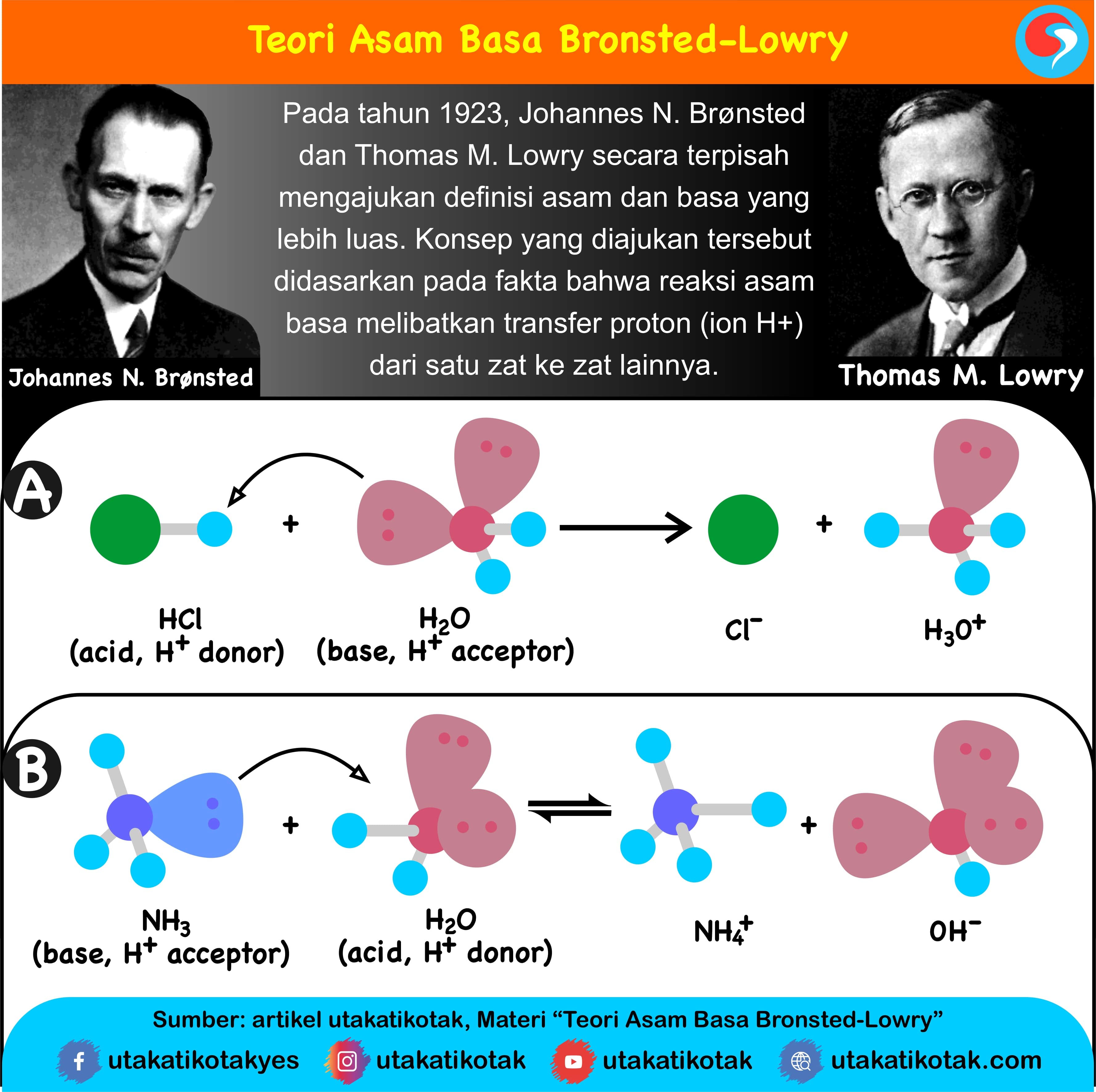
Teori Asam Basa
Fulvio Ciccolo (Unsplash) Dalam pelajaran kimia, terdapat istilah asam basa yang membahas tentang sifat larutan elektrolit. Asam basa ini dibahas dalam beberapa teori, salah satunya adalah teori yang dicetuskan oleh Arrhenius. Dalam buku berjudul Kimia: Asam, Basa dan Larutan Penyangga yang disusun oleh Dodi Satriawan, Wahidin, Chusnur.

diantara senyawa berikut yang bersifat asam menurut Arrhenius adalah YouTube
Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -. Gas asam klorida (HCI) yang sangat larut didalam air.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
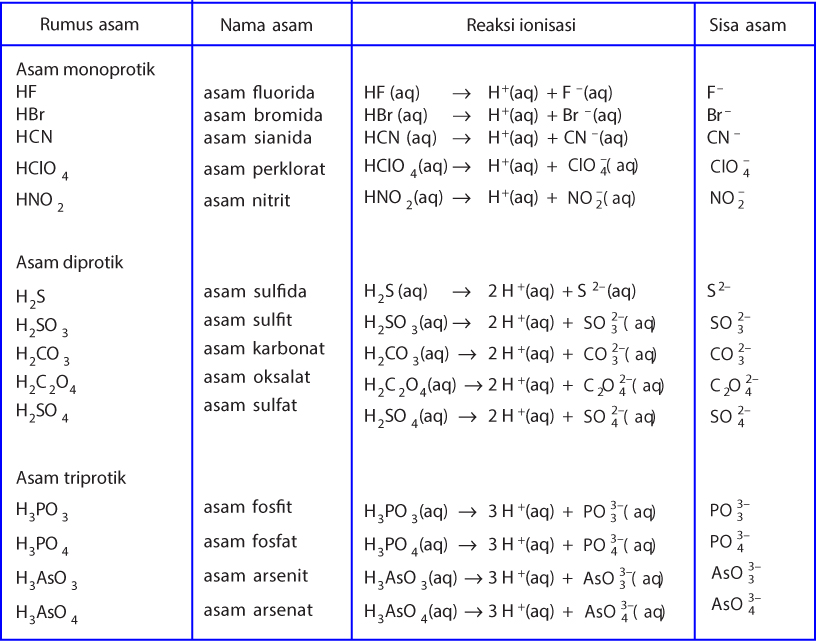
Menurut Shikha Munjal dan Aakash Singh dalam The Arrhenius Acid and Base Theory (2020), asam kuat memiliki konsentrasi ion hydronium yang terbentuk sama dengan konsentrasi asam. Sedangkan asam lemah memiliki konsentrasi ion hidronium yang terbentuk lebih kecil daripada ion hidrogennya. Contohnya adalah asam klorida, reaksi disosiasi asam.

TEORI ASAM BASA ARRHENIUS
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
and of the temperature. If this fraction were unity, the Arrhenius law would reduce to. k = A (17.3.4) (17.3.4) k = A. In other words, A is the fraction of molecules that would react if either the activation energy were zero, or if the kinetic energy of all molecules exceeded Ea — admittedly, an uncommon scenario.
Teori Asam Basa Arrhenius dan PH Larutan Asam Basa ( file swf ) Ilmu Fisika and Biologi
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
Menurut Teori Asam Basa Arrhenius bahwa Asam ialah Zat yang jika didalam Air dapat melepaskan Ion Hidrogen (H+), Ion - Ion Hidrogen yang dihasilkan oleh Asam tersebut ketika dilarutkan di dlm Air terikat pada Molekul - Molekul Air (H2O) dlm bentuk Ion Hidronium adalah Ion yang Positif yg dibentuk oleh sebuah Proton (Ion Hidrogen) pada.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Beberapa ilmuwan yang mengembangkan teori asam basa yaitu Arrhenius, Bronsted-Lowry, dan Lewis. Teori Asam Basa Lewis Pada tahun 1932 G. N. Lewis, seorang ahli kimia dari Amerika mengartikan asam sebagai suatu zat yang dapat menerima sepasang elektron, dan basa adalah zat yang dapat memberikan sepasang elektron.

Definisi Asam Menurut Arrhenius Adalah
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

Teori Asam Basa
Percobaan dilakukan melalui uji kualitatif diantaranya percobaan rekristalisasi asam benzoate dan percobaan sublimasi.. penelitian ini adalah metode sulfonasi.. benzoat pada selai buah.

TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.. Contoh asam menurut Arrhenius adalah senyawa HCl yang apabila dilarutkan dalam air akan terionisasi menjadi: HCl (g) + H 2 O (l) → Cl-(aq) + H 3 O+ (aq)

TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam.